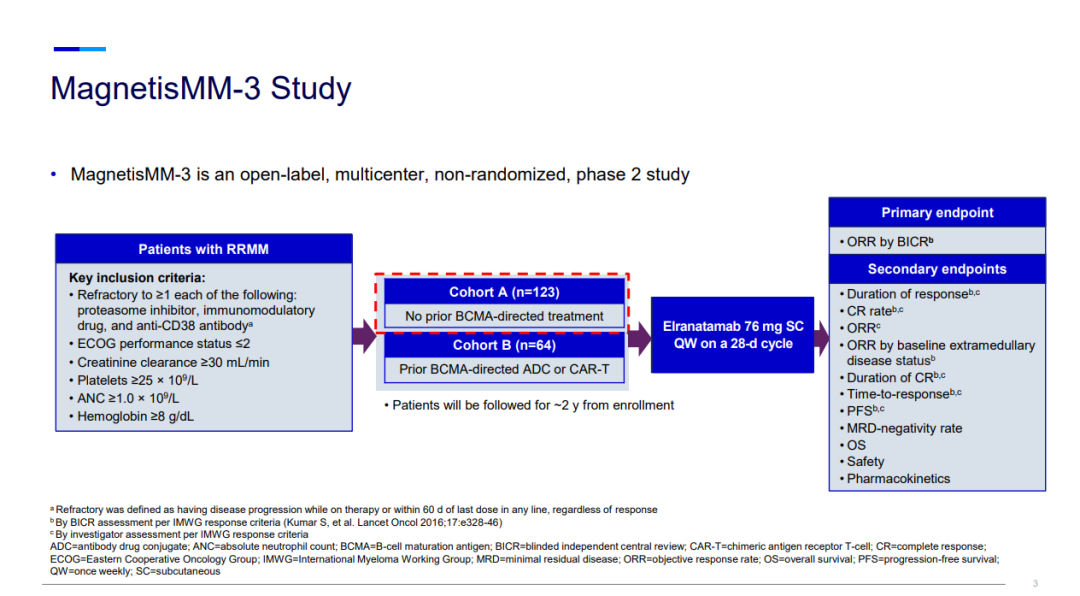
2月22日,輝瑞宣布美國食品藥品監督管理局(FDA)已授予其CD3/BCMA雙特異性抗體elranatamab的生物制品許可申請(BLA)優先審評資格,預計FDA將在2023年對該申請做出決定。這也預示著,elranatamab有望繼強生/Genmab的teclistamab之后,成為全球第二款獲批上市的CD3/BCMA雙特異性抗體。同時,歐洲藥品管理局(EMA)也已接受了elranatamab的上市許可申請(MAA)。Elranatamab旨在結合在多發性骨髓瘤 (MM) 細胞表面高度表達的BCMA和T細胞表面的CD3受體,激活T細胞以殺死骨髓瘤細胞。Elranatamab的BLA和MAA主要基于來自MagnetisMM-3 (NCT04649359) 隊列A(BCMA-na?ve,n=123)的數據,這是一項正在進行的開放、多中心、單臂II期臨床研究,旨在評估elranatamab 單藥治療復發難治性多發性骨髓瘤 (RRMM)患者的安全性和有效性,納入的患者此前接受過包括蛋白酶體抑制劑、免疫調節劑和抗CD38單克隆抗體等至少三類療法治療。MagnetisMM-3研究中,患者每周接受一次皮下(SC)注射elranatamab (76mg,QW),周期為28天。接受6個或更多周期治療并達到部分緩解或更好緩解至少2個月的患者,可調整給藥間隔為每兩周一次(Q2W)。
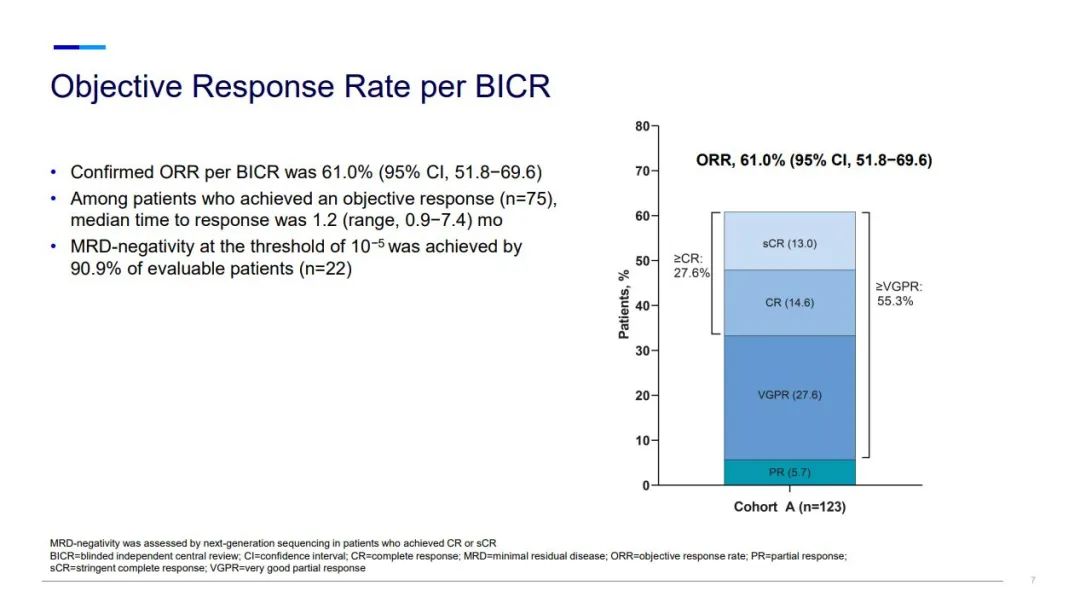
在中位隨訪10.4個月時,接受elranatamab作為首次BCMA靶向治療的患者達到了61%的高客觀緩解率以及55%的非常好的部分緩解率,MagnetisMM-3的結果還表明elranatamab具有可控的安全性。
2022年11月,輝瑞公司曾宣布elranatamab被FDA授予突破性療法認定。此外,elranatamab已被FDA和EMA分別授予治療MM的孤兒藥物稱號,以及快速通道指定和PRIME計劃。英國藥品和保健品監管局 (MHRA) 也授予elranatamab創新藥物指定。FDA已將elranatamab納入ORBIS項目,該項目是在多個國家同步提交和審評腫瘤產品的框架,可能會加快美國以外某些國家/地區的批準。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容