
2023-02-10 00:00:00來源:百奧利盟官方發布瀏覽量:182
【摘要】
近日,中共中央、國務院印發了《質量強國建設綱要》,“加強藥品和疫苗全生命周期管理,完善信息化追溯體系,實現重點類別產品全過程可追溯... ..."全球的生物藥市場正面臨轉型,生物醫藥公司就已經在積極尋求創新科技,以賦能生物醫藥全產業鏈。應用場景包括研究開發的助力、臨床試驗的便捷化、臨床數據的實時監測和精準采集、大數據支持和智能工作流程等長期的數字化轉型推進。 百奧利盟?系統助力精準醫療與創新生物藥企業,賦能全程數字化追溯平臺管理建設。
展望未來
新華社北京2月6日電 近日,中共中央、國務院印發了《質量強國建設綱要》,并發出通知,要求各地區各部門結合實際認真貫徹落實。

《質量強國建設綱要》建設質量強國是推動高質量發展、促進我國經濟由大向強轉變的重要舉措,是滿足人民美好生活需要的重要途徑。為統籌推進質量強國建設,全面提高我國質量總體水平,制定本綱要。
五、加快產品質量提檔升級
(十)加強藥品和疫苗全生命周期管理,推動臨床急需和罕見病治療藥品、醫療器械審評審批提速,提高藥品檢驗檢測和生物制品(疫苗)批簽發能力,優化中藥審評機制,加速推進化學原料藥、中藥技術研發和質量標準升級,提升仿制藥與原研藥、專利藥的質量和療效一致性。加強農產品食品藥品冷鏈物流設施建設,完善信息化追溯體系,實現重點類別產品全過程可追溯。
八、增強企業質量和品牌發展能力
(二十)提升全面質量管理水平。鼓勵企業制定實施以質取勝生產經營戰略,創新質量管理理念、方法、工具,推動全員、全要素、全過程、全數據的新型質量管理體系應用,加快質量管理成熟度躍升。強化新一代信息技術應用和企業質量保證能力建設,構建數字化、智能化質量管控模式,實施供應商質量控制能力考核評價,推動質量形成過程的顯性化、可視化。引導企業開展質量管理數字化升級、質量標桿經驗交流、質量管理體系認證、質量標準制定等,加強全員質量教育培訓,健全企業首席質量官制度,重視質量經理、質量工程師、質量技術能手隊伍建設。
九、推進質量治理現代化
(二十七)優化質量監管效能。建立健全產品質量安全風險監控機制,完善產品傷害監測體系,開展質量安全風險識別、評估和處置。建立健全產品質量安全事故強制報告制度,開展重大質量安全事故調查與處理。健全產品召回管理體制機制,加強召回技術支撐,強化缺陷產品召回管理。構建重點產品質量安全追溯體系,完善質量安全追溯標準,加強數據開放共享,形成來源可查、去向可追、責任可究的質量安全追溯鏈條。
回顧歷史
1959年,西德兒科醫生Weidenbaeh首先報告了一例女嬰的罕見畸形,稱為“海豹肢畸形兒”及“海豹胎”。從1956年進入市場到1962年撤藥,震驚全世界的“反應停”事件,波及德國、日本、歐洲等國家1萬余例“海豹肢畸形”嬰兒。醫學研究表明,“海豹胎”病因是婦女在懷孕初期服用“反應停”所致,也是藥物審批制度不完善的產物。這一悲劇增強了人們對藥物毒副作用的警覺,從而進一步完善了現代藥物的審批制度。
1972~1973年,新西蘭、丹麥率先實施了GLP實驗室登記規范。美國食品藥品監督管理局(Food and Drug Administration, FDA)也于1976年11月頒布了GLP法規草案,并于1979年正式實施。1981年,國際經濟合作與發展組織(Organization for Economic Cooperation and Development, OECD)制定了GLP原則。80年代中,日本、韓國、瑞士、瑞典、德國、加拿大、荷蘭等國也先后實施了GLP規范。GLP逐漸成為國際通行的確保藥品非臨床安全性研究質量的規范。
我國從1991年開始起草GLP,并于1993年原國家科委頒布、1994年生效。1998年國家食品藥品監督管理局(NMPA)根據國際GLP的發展結合我國的實際情況,頒布了《藥品非臨床研究質量管理規范》,并于1999年實施。2007年規定未在國內上市銷售的化學原料藥及其制劑、生物制品,未在國內上市銷售的從植物、動物、礦物等物質中提取的有效成分及其制劑以及中藥注射劑等的新藥非臨床安全性評價研究必須在經過GLP認證、符合GLP要求的實驗室進行,這標志著我國從開始的GLP試行到目前強制性實施。
全球數字化轉型進程加速 從長期轉型變成短期必需

全球的生物藥市場正面臨轉型,在新冠疫情爆發之前,生物醫藥公司就已經在積極尋求創新科技,以賦能生物醫藥全產業鏈。應用場景包括研究開發的助力、臨床試驗的便捷化、臨床數據的實時監測和精準采集、大數據支持和智能工作流程等長期的數字化轉型推進。疫情爆發后,數字化轉型的進程被迫大幅加速,從長期轉型變成了短期必需。
在全球趨勢的影響下和國內雙循環發展模式的推動下,中國生物醫藥產業的創新逐漸發展出自己的特色,主要體現在政府機構對于生物創新藥的重視、生物醫藥產業數字化轉型的領先、人工智能對生物醫藥全產業鏈的賦能持續加大等方面。
預計到2025年,用藥診療模式將出現很大的轉變,臨床醫生將以具備4P要素-預測性(predictive)、預防性(preventative)、個性化(personalized)和參與性(participatory)的治療方法為基礎來進行診斷和診療的相關決策。具備4P要素的產品分別為數字診療(人工智能、納米科技等)與細胞和基因治療(表觀遺傳學、細胞治療、基因編輯等)。
百奧利盟BioTechLeague
為全球精準醫療和創新生物藥企業提供全程數字化解決方案
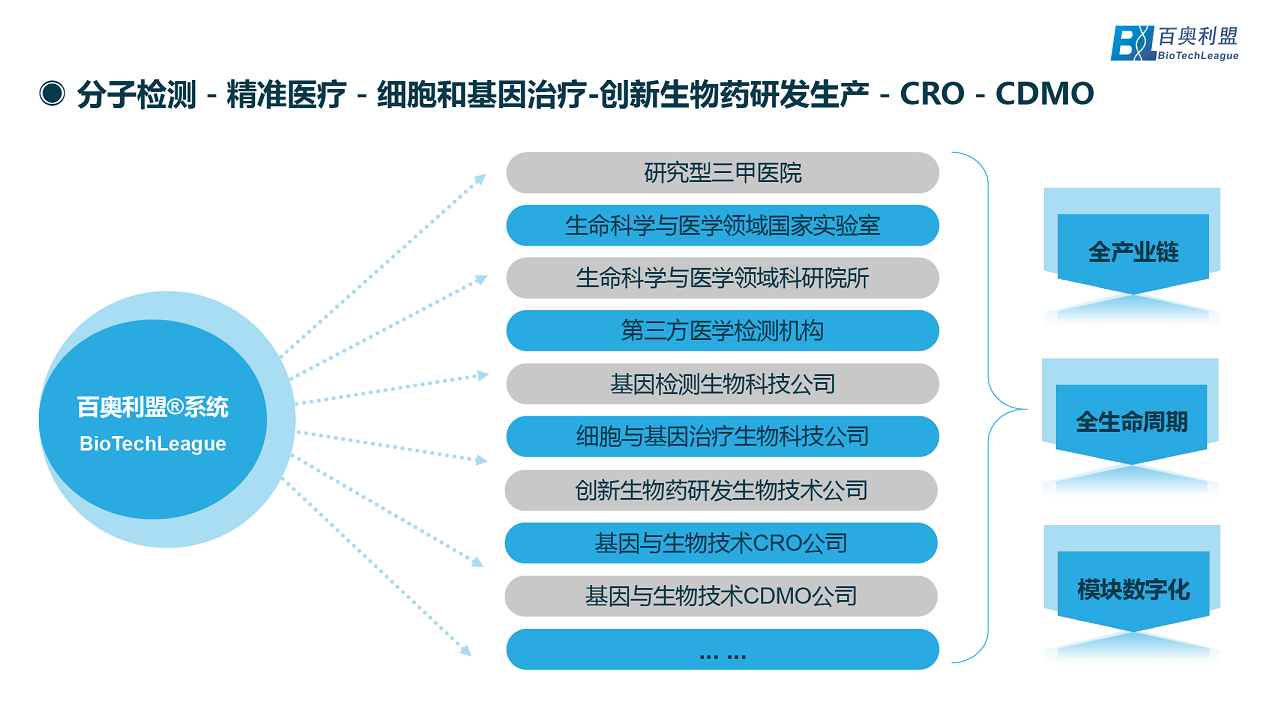
百奧利盟致力于為全球精準醫療和創新生物藥企業提供全程數字化解決方案,服務的客戶涵蓋研究型三甲醫院、生命科學與醫學領域國家實驗室、生命科學與醫學領域科研院所、第三方醫學檢測機構、基因檢測生物科技公司、細胞與基因治療生物科技公司、創新生物藥研發生物技術公司、基因與生物技術CRO公司、基因與生物技術CDMO公司等生命科學領域。
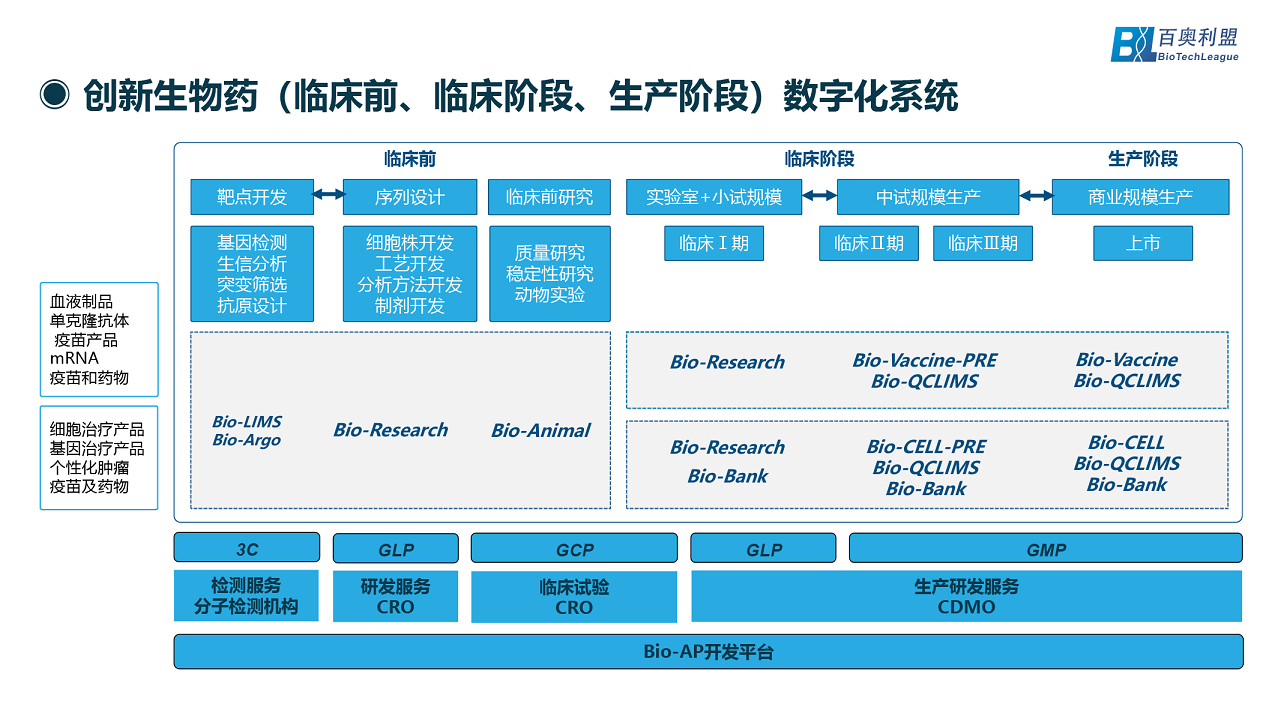
創新生物藥(臨床前、臨床階段、生產階段)都需要怎樣的數字化系統?首先針對生物制品行業或者生物藥行業不同產品(如:血液制品、抗體、mRNA疫苗藥物、個性化細胞與基因治療、mRNA個性化腫瘤藥物等)。在臨床前靶點開發階段需要基因測序、生信分析、突變篩選、抗原設計等,可使用Bio-LIMS智慧實驗室管理系統、Bio-Argo生物信息平臺的系統產品來解決實驗室以及生信分析等的數字化系統。在序列設計的各種實際開發,包括細胞株開發、工藝開發、分析方法開發、制劑開發等,都可以用Bio-Research針對研發實驗室的數字化系統;在臨床前階段質量研究、穩定性研究、動物實驗等,可以用Bio-Animal動物實驗數字化系統做支持。
在臨床階段(實驗室+小試規模、中期規模生產、商業化規模),建議臨床一期階段還是需要研發相關的數字化系統,如Bio-Research研發實驗室管理系統、Bio-Bank生物樣本庫管理系統。在臨床二期、三期規模增長后(特別是三期中試以后),在流程還未完全固定的現實情況下急需偏靈活的、生產相關的系統(生產前期的數字化系統)以及質控、樣本庫系統,如Bio-Vaccine-PRE疫苗生物藥生產數據一體化信息平臺-研發階段、Bio-CELL-PRE細胞和基因治療數據一體化信息平臺-研發階段、Bio-QCLIMS質控信息化管理系統、Bio-Bank生物樣本庫管理系統。
在商業化生產階段,使用Bio-Vaccine疫苗生物藥生產數據一體化信息平臺、Bio-CELL細胞和基因治療數據一體化信息平臺、Bio-QCLIMS質控信息化管理系統、Bio-Bank生物樣本庫管理系統,從研發到臨床到生產形成無縫銜接。對于當前創新生物藥領域,很多企業都處在創業階段(即:中試、臨床、生產中間階段),確實需要相對輕量級、靈活性的,既符合生產標準要求,也符合靈活屬性的數字化系統進行支持。
對于各種企業CRO、CDMO等藥企單位,都面臨著不同機構監管與法規規范要求。針對數字化系統一定要有一個技術開發的基礎平臺,不管是實驗還是生產等環節都構建成模塊化服務進行后期的組裝。
百奧利盟?系統
數字化合規
百奧利盟提供的數字化解決方案完全符合生命科學行業的法規和規范,主要從基本法規、實驗室規范、生產GMP規范三個層面,具體內容如下:
基礎法規層面:符合21 CFR Part11(電子記錄及電子簽名法規)、 ALCOA+CCEA原則(數據可靠性原則)以及中華人民共和國電子簽名法;
實驗室規范層面:符合GLP(良好實驗室規范)、ISO17025(檢驗與校準實驗室證),ISO15189(醫學實驗室認證),CAP/CLIA(美國病理家協會實驗體系認證)等相關法規對計算機化系統的要求;
生產GMP規范層面:符合 ISPE GAMP5,NMPA《計算機化系統》、NMPA 《藥品記錄與數據管理規范》、 NMPA 《生物制品》、 NMPA 《細胞治療產品生產質量管理指南(試行)》以及FDA和歐盟的相關法規和規范;
參考資料:
《中國生物醫藥創新趨勢展望》
相關法規和規范:
? HIPPA(病人隱私信息保護法案)
? 中國人類遺傳資源管理條例
? 21 CFR Part11(電子記錄及電子簽名法規)
? 中國電子簽名法
? ALCOA+CCEA原則(數據可靠性原則)GMP相關規范
? NMPA 2010年5月 GMP附錄《計算機化系統》《確認與驗證》
? NMPA 2020年2月 《藥品記錄與數據管理規范》
? NMPA 2020年7月 GMP附錄 《生物制品》
? NMPA 2020年1月 《藥品生產質量管理規范-細胞治療產品附錄》COI(身份鏈)COC(監管鏈)
? EU 歐盟藥事法規第4卷GMP,附錄11《計算機化系統》
? ISPE GAMP5-2 良好自動化生產實踐指南,遵從GxP計算機化系統監管的風險管理方法
? ISPE PHARMA4.0
? WHO GMP 2003,Annex4實驗室相關規范
? GLP-計算機化系統的要求
? PCR臨床實驗室規范
? ISO17025(檢驗與校準實驗室認證)
? ISO15189(醫學實驗室認證)
? ASTM E 2066(實驗室信息管理系統的鑒定標準導則)
? ASTM E 1578(實驗室信息管理系統(LIMS)的標準指南)
? CAP/CLIA(美國病理家協會實驗體系認證)
? AAALAC(國際實驗動物規范)
? AABB(生物樣本庫國際認證)