
2023-01-10 11:12:50來源:博藥/森林瀏覽量:292
導讀:創新是不變的主題詞
2022年,全球宏觀經濟面臨挑戰,疊加新冠疫情,醫藥行業經歷了艱難的一年。
但回顧過去一年,我們發現,多款創新療法獲得監管機構批準,2022年仍然是創新藥豐收的一年。
美國FDA批準37款新藥,“first-in-class”療法占比過半
2022年,美國FDA藥物評價和研究中心(CDER)批準了37款新藥,包括22款小分子藥和15款生物藥。
與往年FDA每年批準新藥近50款相比,今年獲批新藥數量有所下降,但是創新的步伐并沒有減緩。據統計,2022年CDER批準了21款“First-in-class”療法,超過獲批新藥總數一半。
美國FDA歷年批準新藥數量
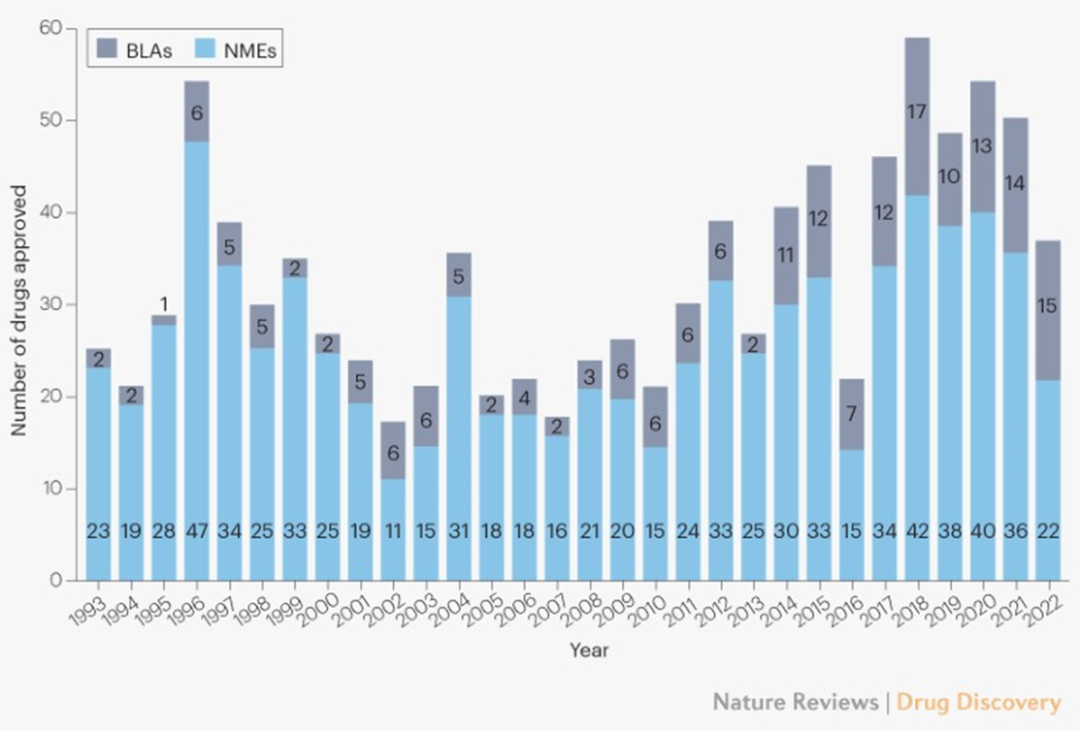
圖片來源:Drug Discovery
從企業來看,百時美施貴寶 (BMS) 是最大的贏家,全年有 3 種新藥獲批上市,包括SOTYKTU、CAMZYOS和OPDUALAG。此外,羅氏和賽諾菲也各有2款新藥獲批上市。
從疾病領域來看,2022年FDA批準的新藥中腫瘤藥占比最高(30%),有11款,涉及多種常見腫瘤及罕見腫瘤;其次是罕見病、自身免疫、感染等。
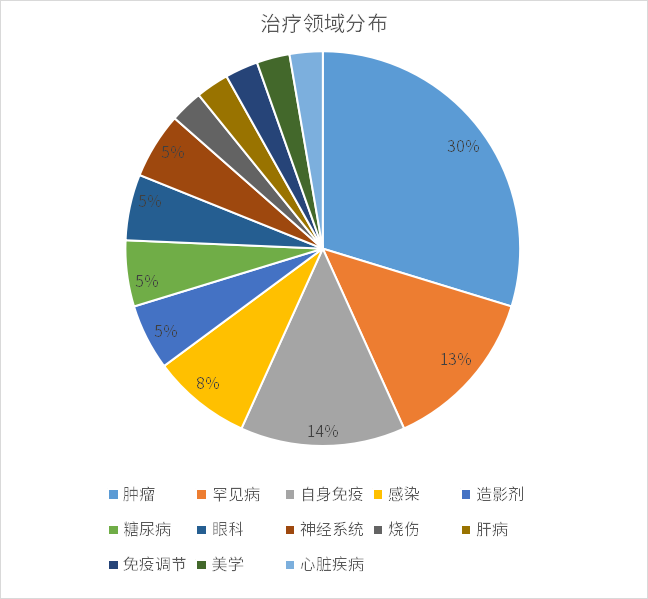
資料來源:藥智數據
從藥物類型來看,2022年FDA批準的新藥有:
1. 17個小分子藥物:包括丙酮酸激酶別構激活劑、心肌肌球蛋白別構抑制劑、TYK2別構抑制劑和HIV-1衣殼抑制劑等;
2. 2個造影劑:釓絡合物造影劑、超極化Xe 129造影劑;
3. 6個單抗:包括首個C1s抗體,首款延緩一型糖尿病發生的CD3抗體,首個LAG-3抗體,首個IL-36R抗體等。
4. 4款雙特異性抗體/蛋白療法:VEGF-A/Ang-2、CD3/BCMA、CD20xCD3雙抗和TCR雙特異性蛋白;
5. 3個其他蛋白、1個ADC、1個多肽、1個環肽、1個RNAi療法、1個植物藥物產品。
表1. 2022年FDA批準的新藥
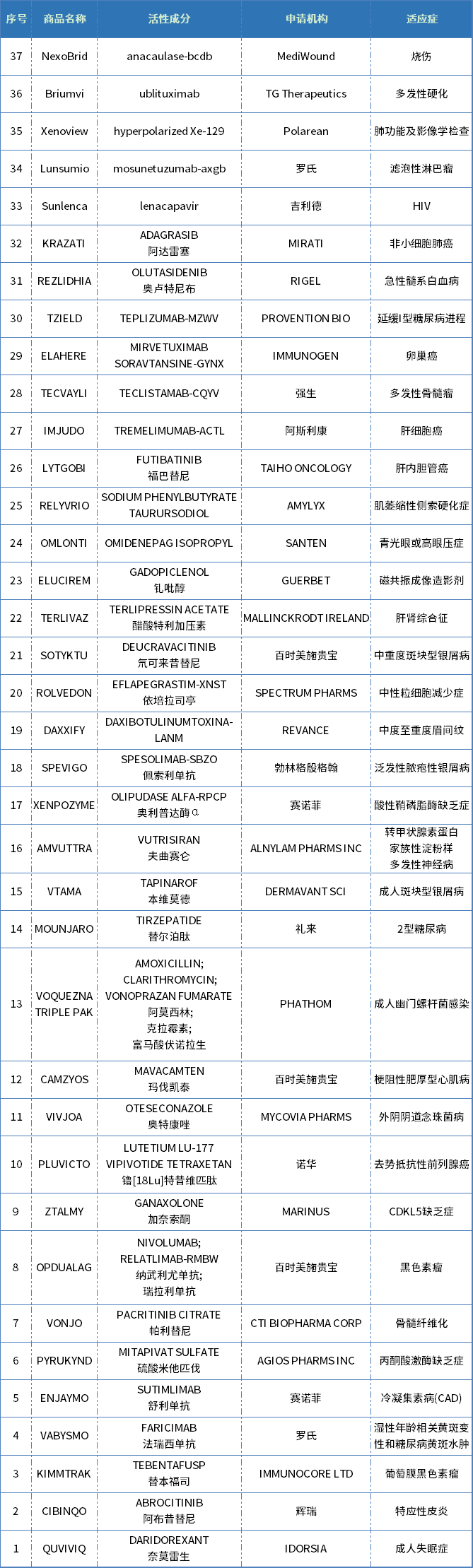
注:清單包括CDER批準的多種新藥及部分生物制品,不包括疫苗、過敏性產品、血液和血液制品、血漿衍生物、細胞和基因治療產品,以及生物制品評估和研究中心在2022年批準的其他產品。
數據來源:美國FDA官網、藥智美國上市藥品數據庫
除了CDER,美國FDA的生物制品評估和研究中心(CBER)也批準了15項生物制品許可申請(BLA),涉及多個重磅新藥,包括傳奇生物的BCMA CAR-T以及多款款基因療法。
多款創新療法在歐盟、日本首批上市
2022年,美國以外地區(主要是歐盟和日本)也批準了多款新藥上市,其中歐盟CHMP推薦上市的新藥中有8款全球首批新藥,日本PMDA也批準了十余款全球首批新藥。
2022年,歐洲藥品管理局(EMA)人用藥品委員會(CHMP)完成92款新藥上市申請的審評,對其中89款新藥給予了積極意見,其中新藥51款,包括8款全球首批新藥。
表2. 2022年度CHMP推薦上市全球首批新藥

數據來源:EMA官網、藥智歐盟上市藥品數據庫
這8款首批新藥中7款為生物藥,包括2款基因治療藥物、1款細胞治療藥物、3個抗體類藥物以及1個蛋白類藥物,僅1款化藥小分子藥物,為來自吉利德的HIV新藥Sunlenca。
2022年,CHMP推薦上市了3個雙抗藥物,其中兩個為全球首批的first-in-class產品,分別為羅氏公司開發的CD20 x CD3靶向雙特異性抗體Lunsumio (mosunetuzumab)以及強生公司開發的首個全人源化BCMA x CD3 靶向雙特異性抗體Tecvayli(teclistamab),適應癥均為血液瘤。
此外,2022年日本獨立行政法人藥品醫療器械綜合機構(Pharmaceuticals and Medical Devices Agency,PMDA)批準一百多個新藥(包含化學藥品、生物制品,不包含細胞療法和基因治療產品)的上市許可,其中日本PMDA全球首次批準上市許可的含新有效成份的藥品超過十個。
表3. 2022年PMDA全球首批新藥
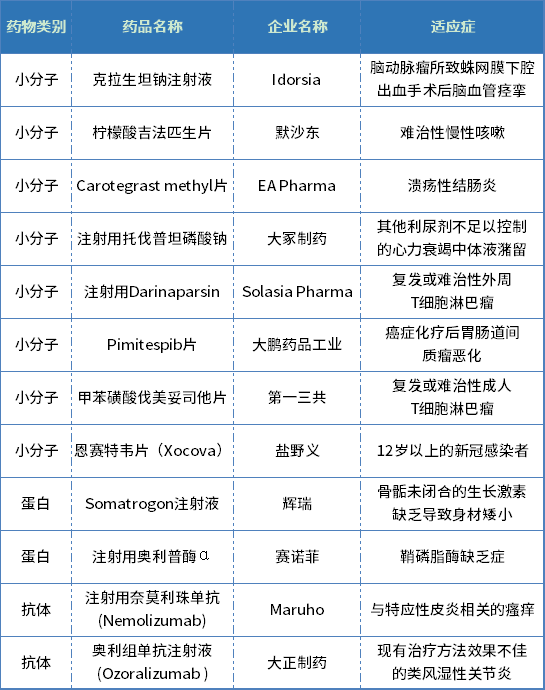
數據來源:PMDA官網、藥智日本上市藥品數據庫
日本厚生勞動省醫藥食品局在藥品上市申請相關的發文中規定,含新有效成份的藥品是指藥品中含有和已在日本獲得上市許可的藥品(包括日本藥典中的藥品)不同的有效成份。藥品若含有已在日本上市的活性成份的酯或鹽,也屬于含新有效成份,如大冢制藥的注射用托伐普坦磷酸鈉(為已在日本獲批的活性成份托伐普坦的磷酸酯鈉鹽)。
與歐盟不同,2022年日本PMDA全球首次批準的含新有效成份的藥品中,大部分是小分子藥,另有兩個抗體、兩個蛋白類新藥。
細胞和基因療法迎來大爆發
2022年對于全球生物醫藥產業來說并不容易,從上文可以看出去年獲批新藥數量較前幾年有所下降。但值得注意的是,2022年細胞和基因療法獲批數量創下新高,共有8款。
表4. 2022年全球批準的細胞和基因療法
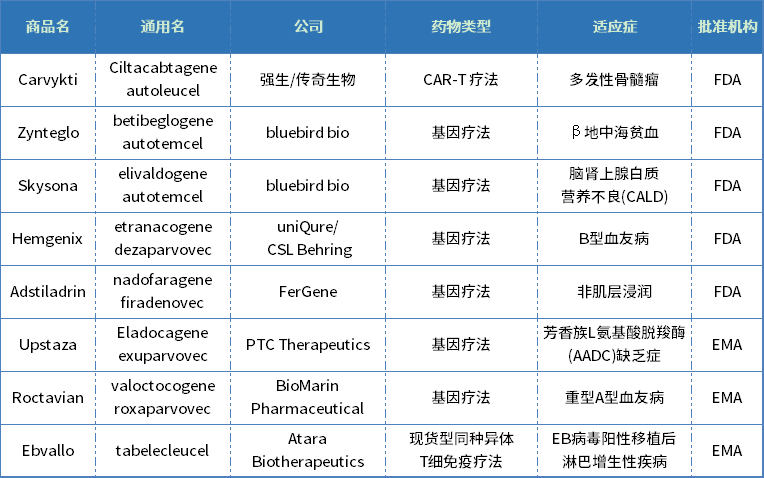
數據來源:EMA官網、FDA官網
以細胞和基因療法為代表的創新療法,變革了傳統的醫學模式,讓許多罹患致命性疾病的患者看到了新的希望。經過數年間的發展,這一領域的發展已初具規模。
2022年美國FDA批準了4款基因療法。從適應癥來看,以罕見病治療為主。由于罕見病人群狹窄,疊加成本高等因素,基因療法往往定價不菲,例如藍鳥生物的Zynteglo在美國定價280萬美元,Skysona定價300萬美元,CSL Behring的Hemgenix定價更是達到了350萬美元,成為全球最貴的藥物。
值得一提的是,2022年還有一款治療膀胱癌的基因療法獲批,昭示著這一療法類型有望突破罕見病的局限,造福更多病患。
2022年美國FDA還批準了1款細胞療法,來自中國本土企業傳奇生物,也是首款獲得FDA批準的國產CAR-T療法。
在歐盟,細胞和基因療法被納入先進技術治療醫學產品(ATMP)管理,2021年歐盟更新完善了基因和細胞治療藥物開發指南,積極引導和扶持ATMP的發展。
2022年,歐盟批準了3款基因治療藥物和3款細胞治療藥物,其中2款基因治療藥物和1款細胞治療藥物屬于全球首批新藥。它們分別是:PTC Therapeutics公司開發的治療罕見病芳香族L-氨基酸脫羧酶(AADC) 缺乏癥的腦內注射基因療法Upstaza(eladocagene exuparvovec),BioMarin Pharmaceutical公司開發的重型血友病A基因療法Roctavian(valoctocogene roxaparvovec),和Atara Biotherapeutics與Pierre Fabre合作開發的同種異體T細胞療法Ebvallo(tabelecleucel)。
值得一提的是,有別于市面上高度定制化的自體CAR-T療法,Ebvallo使用來自供體的EBV T細胞,可三天內快速交付給患者,如最終成功獲批,將是通用型細胞療法達成商業化的里程碑式進展。
結 語
創新是藥物研發永恒的主題。過去幾年,藥物形式迎來突飛猛進的發展,細胞療法、基因療法等新型療法開始革新對既往治療的認知,為罕見病、難治性疾病患者帶來治療的曙光。
鏡頭回到國內,2022年中國有哪些新藥獲批上市?歡迎關注博藥,下期繼續為您解讀~
參考來源:
1. https://mp.weixin.qq.com/s/_x6C2qZVz4t2IhGxuiqcKg
2. https://mp.weixin.qq.com/s/v35jPV0x6Lg5-ybr3H6w6g
3.https://mp.weixin.qq.com/s/KQ3AKLnKMc-zSSfKSVDHwA
4.Asher Mullard, Nature Reviews Drug Discovery, 2022, "2022 FDA approvals".
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容