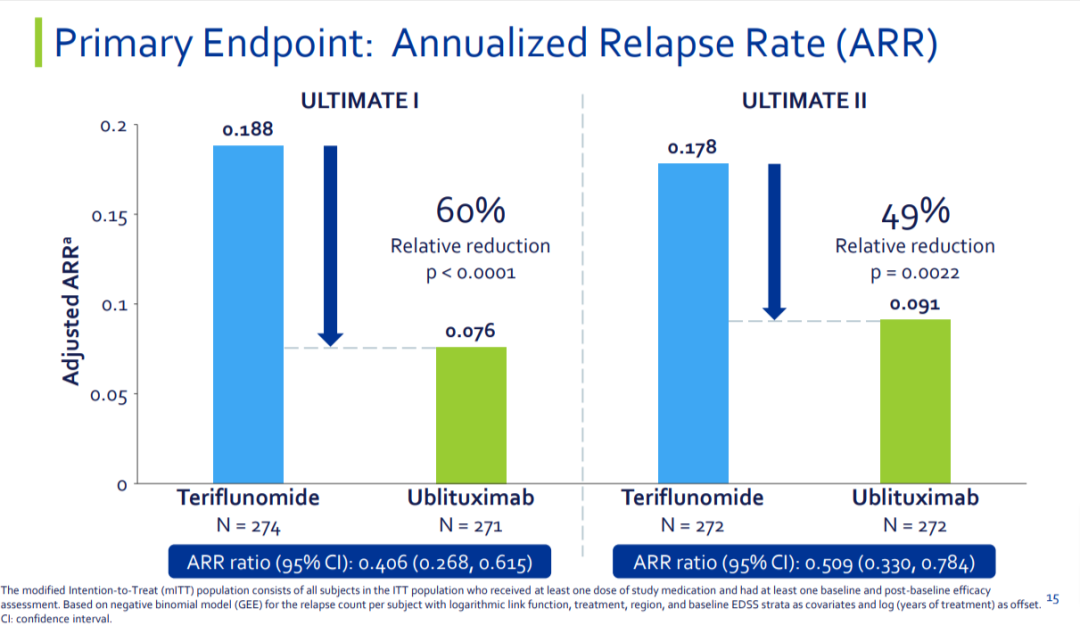
12月28日,TG Therapeutics公司宣布,其CD20單抗ublituximab新藥上市申請獲FDA批準,用于治療復發型多發性硬化癥(RMS)。BRIUMVI? (ublituximab-xiiy)將是PI3Kδ抑制劑umbralisib(厄布利塞 ,商品名:Ukoniq)被FDA撤銷批準后,TG公司的唯一一款上市產品。此次批準主要基于兩項關鍵III期臨床(ULTIMATE I和II)數據。ULTIMATE I和II是2項相同的隨機雙盲、陽性對照、全球多中心III期臨床,旨在評估ublituximab與特立氟胺相比在RMS患者中的療效。結果顯示,治療96周后,與特立氟胺相比,ublituximab顯著降低了RMS患者的年化復發率(ARR)。在ULTIMATE I試驗中,ublituximab組(n=271)和特立氟胺組(n=274)患者的ARR分別為0.08和0.19;在ULTIMATE II試驗中,ublituximab組(n=272)和特立氟胺組(n=272)患者的ARR分別為0.09和0.18。Ublituximab是第一個也是唯一一個被批準用于RMS患者的抗CD20單克隆抗體,第1天給藥150mg時需要長達4小時的輸注時間,第15天可在1小時內輸注450mg藥,隨后每24周輸注450mg。Ublituximab是一款糖工程化單抗,靶向B細胞表達的CD20抗原上的獨特抗原表位。當ublituximab與B細胞結合時,可以引發抗體依賴性細胞毒性(ADCC)和補體依賴性細胞毒性(CDC)等一系列免疫反應以摧毀致病B細胞。這些細胞被認為是導致髓鞘和神經細胞軸突損傷的關鍵因素。Ublituximab的一個獨特之處在于通過糖工程化去除了抗體中某些糖分子,從而顯著增強ublituximab的效力,尤其是ADCC活性。據悉,今年4月15日,基于更新的III期UNITY-CLL試驗的總生存期(OS)數據,TG自愿撤回了U2組合(umbralisib聯合ublituximab)治療慢性淋巴細胞白血病(CLL)和小淋巴細胞淋巴瘤(SLL)成人患者的BLA/sNDA,并自愿停止銷售umbralisib。今年5月31日,FDA也正式撤銷了umbralisib邊緣區淋巴瘤和濾泡性淋巴瘤適應癥的批準。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容