12月8日,Akero Therapeutics公司宣布FDA授予efruxifermin (EFX) 治療非酒精性脂肪性肝炎 (NASH) 的突破性療法認定。去年10月,EFX已獲FDA授予的快速通道資格認定。
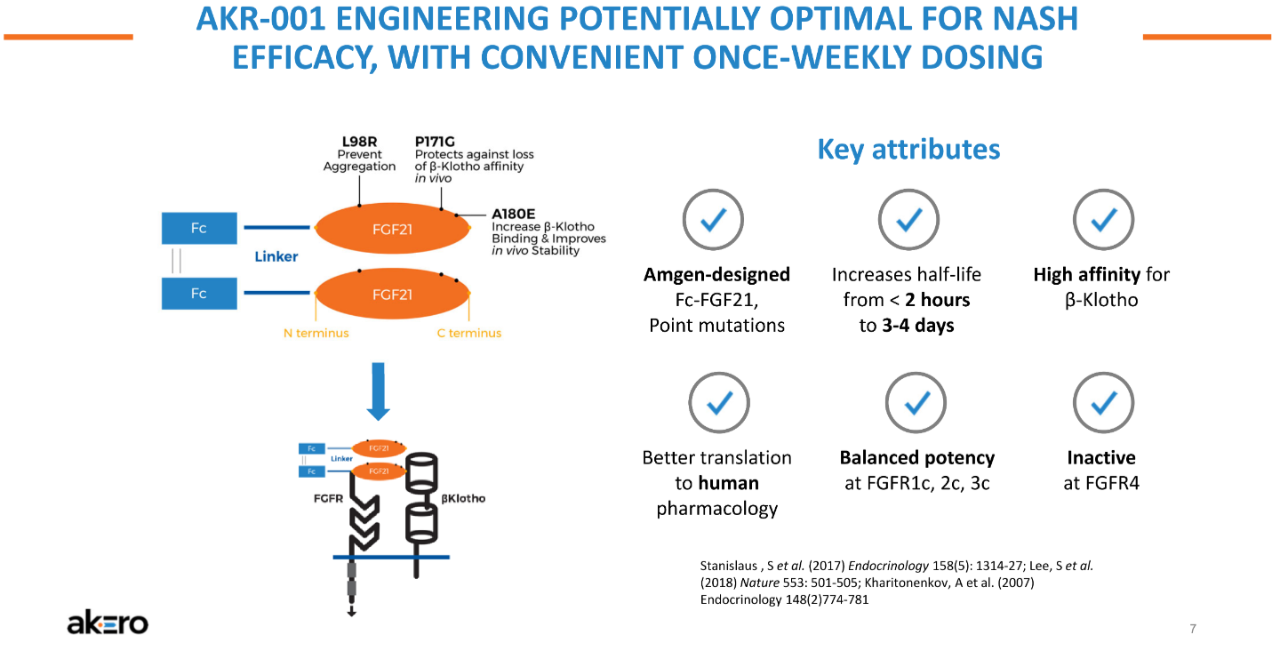
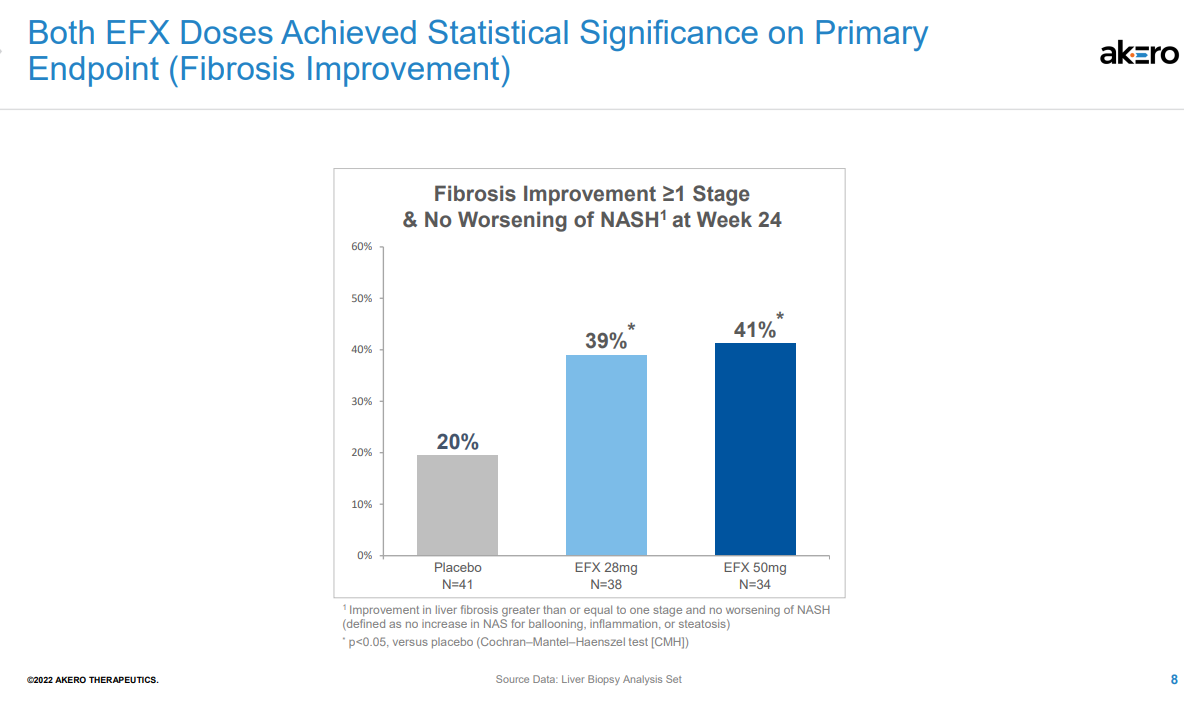
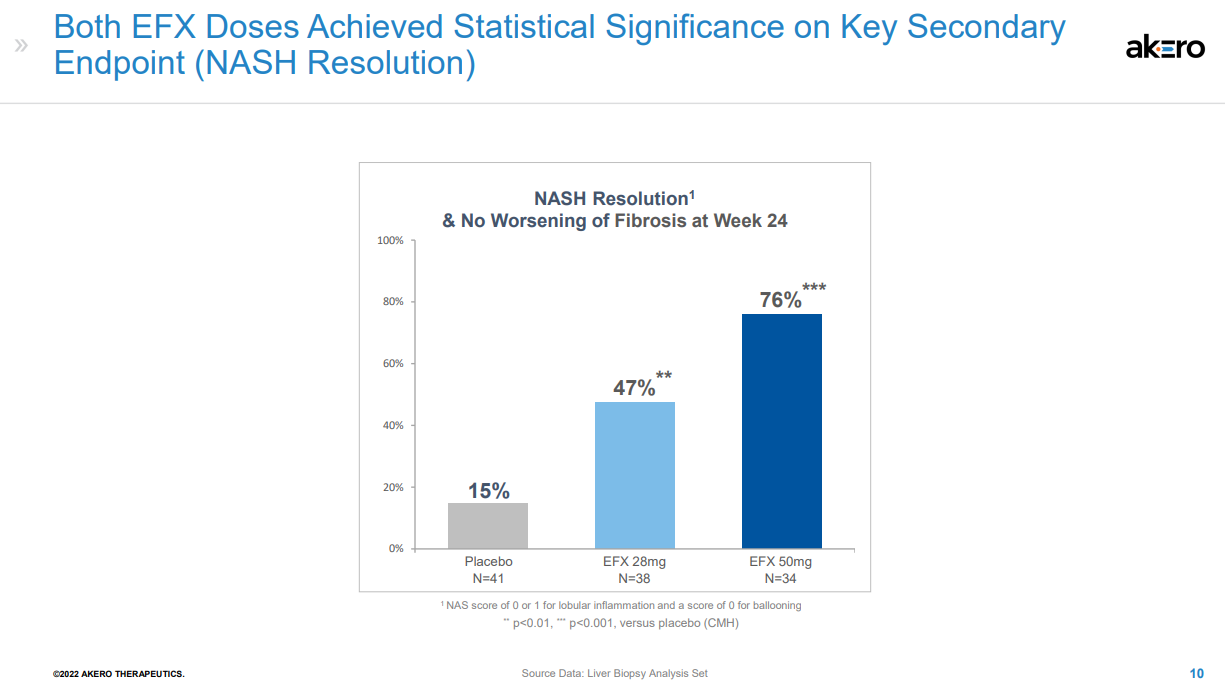
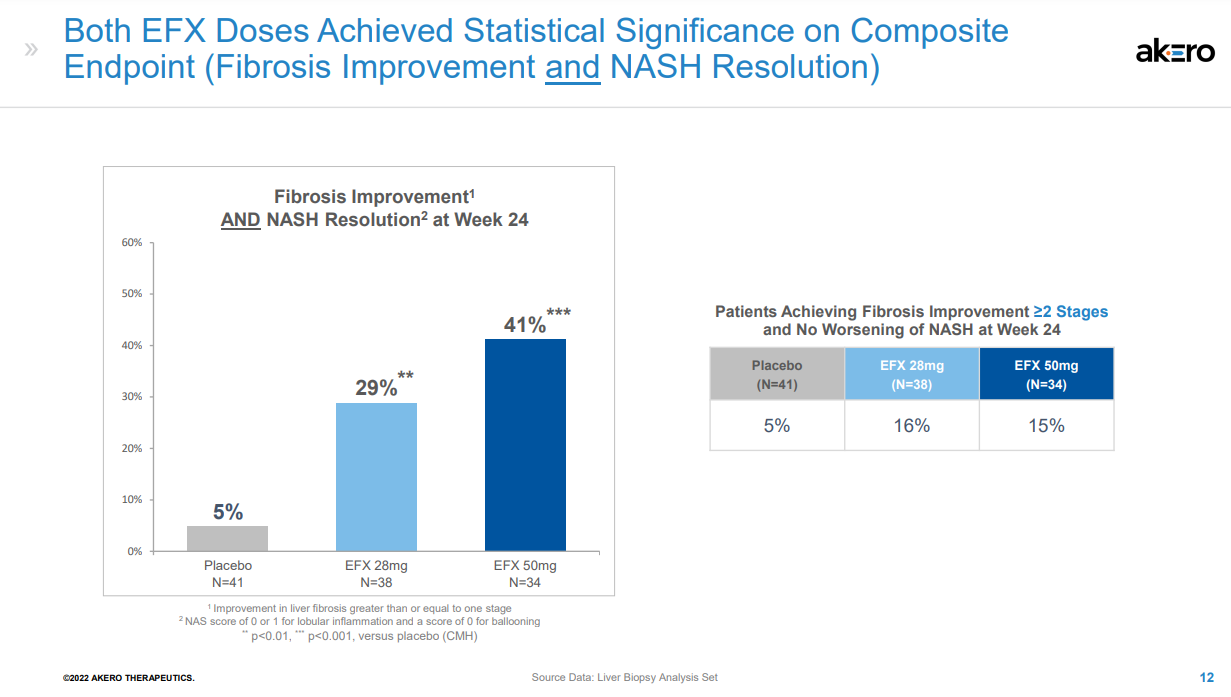
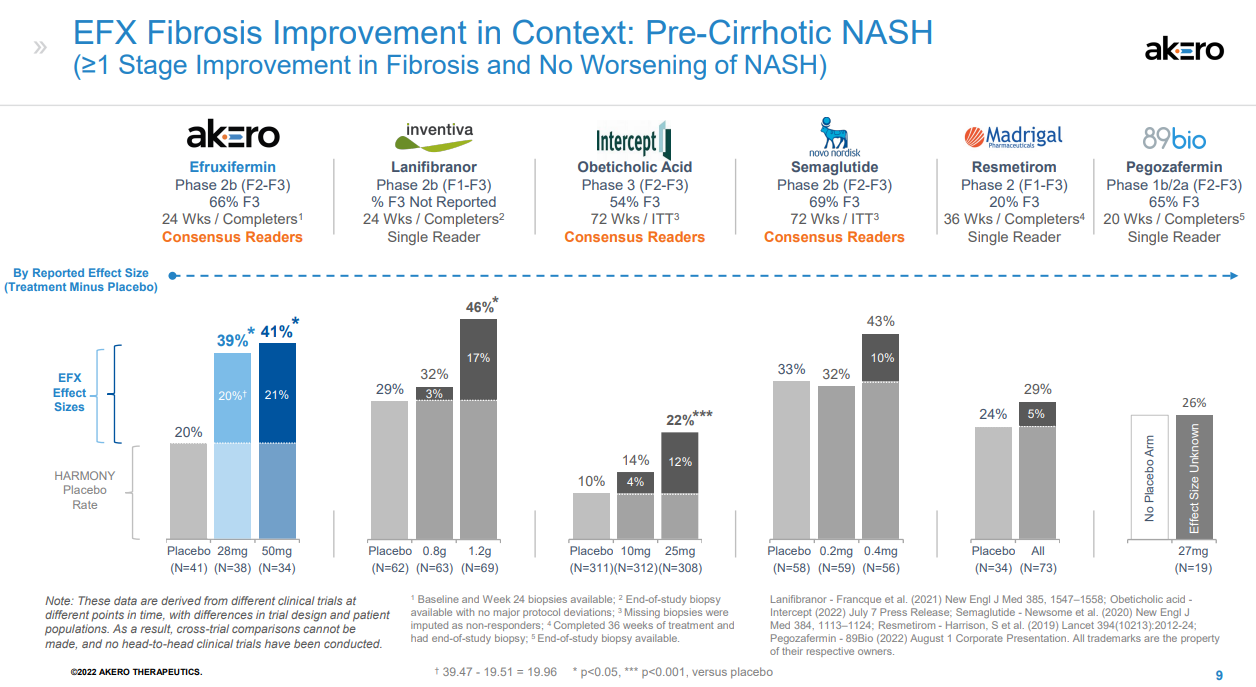
NASH是非酒精性脂肪性肝病的一種嚴重形式,其特征在于脂肪在肝臟中過度堆積,對肝細胞產生應激和損傷,引起炎癥和纖維化,進而發展為肝硬化、肝功能衰竭、癌癥甚至死亡。對整個醫藥行業來說,NASH一直是個難題,其需求遠未得到滿足,目前尚無治愈或特異性的治療方法。據估計,到2026年,NASH市場將達到183億美元。Efruxifermin(AKR-001)是通過模仿天然FGF21的生物活性譜設計而成,融合Fc延長半衰期,同時替換了FGF21序列中的某些氨基酸;半衰期達到3-4天,可以實現每周1次或每2周1次皮下注射給藥。FDA授予EFX突破性療法認定是基于一項IIb期HARMONY研究的積極結果。該研究旨在評估EFX治療肝硬化前NASH(纖維化F2-F3)的安全性和有效性,結果已于今年9月公布,第24周時,皮下注射Efruxifermin 28mg和50mg劑量組均達到了改善肝臟纖維化的主要終點,分別有39%和41%的患者實現了至少一個階段的肝纖維化改善且NASH沒有惡化,而安慰劑組僅為20%。該研究還達到了多個關鍵次要終點。皮下注射EFX 28mg和50mg后,分別有47%和76%的患者在肝纖維化不惡化的情況下獲得了NASH緩解,而安慰劑組為15%。另外,28mg和50mg劑量組分別有29%和41%的患者達到了肝纖維化改善和NASH緩解兩個終點,而安慰劑組為5%。本次研究結果達到的組織學改善效果是已披露數據NASH新藥中最好的,如果獲批上市,有望成為治療NASH的best-in-class藥物。該公司表示,另一項IIb期SYMMETRY研究已于2021年7月啟動,旨在評估EFX用于因NASH引起的代償期肝硬化(F4)、肝功能Child-Pugh A級患者的療效與安全性,預計2023年下半年公布結果。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容