BTK是非受體蛋白酪氨酸激酶TEC家族的一員,在B細(xì)胞受體(BCR)介導(dǎo)的信號通路中起關(guān)鍵作用。BTK可通過多種途徑激活,參與調(diào)節(jié)B細(xì)胞的增殖、成熟、分化、凋亡與遷移。研究表明,BTK在多種B細(xì)胞惡性腫瘤中高表達(dá)。鑒于BTK在B細(xì)胞的一生中都有著不可或缺的作用,其已成為B細(xì)胞惡性腫瘤治療領(lǐng)域的兵家必爭之地。
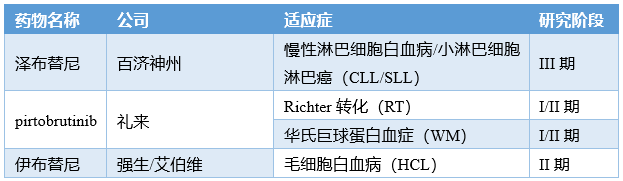
截至目前,全球已上市BTK抑制劑共5款,分別為tirabrutinib(吉利德/小野制藥)、澤布替尼(百濟(jì)神州)、伊布替尼(強(qiáng)生/艾伯維)、阿卡替尼(阿斯利康/安斯泰來)和奧布替尼(諾誠健華/渤健)。此外,還有7款處于III期臨床階段。憑借其優(yōu)異的抗腫瘤活性,伊布替尼至今穩(wěn)坐BTK抑制劑“老大”寶座,后來者都只能先委屈一下當(dāng)“小弟”。但隨著BTK耐藥突變的出現(xiàn),“老大”的實(shí)力有所削弱,“小弟”們正在努力抓住機(jī)會往上擠。在下周即將召開的2022美國血液學(xué)會年會上,我們可以看看“老大”和“小弟”們都有些什么實(shí)力~
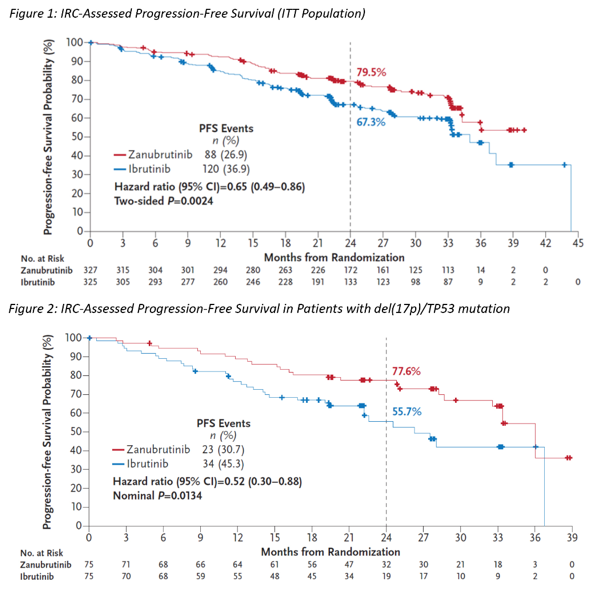
ALPINE研究是一項(xiàng)隨機(jī)、開放標(biāo)簽的III期臨床試驗(yàn),截至2022年8月8日,共納入652例患者,旨在評估澤布替尼(每日2次,160mg)對比伊布替尼(每日1次,420mg)治療復(fù)發(fā)性或難治性慢性淋巴細(xì)胞白血病/小淋巴細(xì)胞淋巴瘤(R/R CLL/SLL)患者的療效和安全性。研究的主要終點(diǎn)為研究者評估的客觀緩解率(ORR),次要終點(diǎn)包括研究者和獨(dú)立評審委員會(IRC)評估的PFS、緩解持續(xù)時(shí)間(DOR)等。IRC和研究者評估的結(jié)果均顯示,澤布替尼優(yōu)效于伊布替尼(HR:0.65;95% CI:0.49-0.86; 雙側(cè)P值=0.0024)。在主要的預(yù)定義亞組中,包括在不同IGHV狀態(tài)和攜帶del(17p)/TP53突變的患者亞組中,澤布替尼組的PFS均優(yōu)效于伊布替尼組。此外,與伊布替尼組相比,澤布替尼組的ORR更高(86.2% vs 75.7%,雙側(cè)P值=0.0007)。安全性方面,澤布替尼的總體耐受性良好。與伊布替尼組相比,澤布替尼組的終止治療總發(fā)生率(26.3% vs 41.2%)更低,其中包括因AE(16.2% vs 22.8%)或疾病進(jìn)展(PD,7.3% vs12.9%)而終止治療。此外,與伊布替尼組相比,澤布替尼組的房顫/房撲發(fā)生率較低(5.2% vs 13.3%)。澤布替尼沒有因心臟疾病引起的5級AE,而伊布替尼組報(bào)告了6例(1.9%)。▌pirtobrutinib單藥治療侵襲性彌漫性大B細(xì)胞淋巴瘤
BRUIN研究是一項(xiàng)非隨機(jī)、開放標(biāo)簽的I/II期臨床試驗(yàn),旨在評估pirtobrutinib治療CLL/SLL或非霍奇金淋巴瘤(NHL)患者的療效和安全性。此次報(bào)告的是RT(Richter轉(zhuǎn)化)隊(duì)列的結(jié)果。
RT指從CLL/SLL轉(zhuǎn)化為侵襲性彌漫性大B細(xì)胞淋巴瘤(DLBCL),其預(yù)后極差,中位OS為3-11個(gè)月,目前尚無批準(zhǔn)療法。pirtobrutinib是一種高選擇性、非共價(jià)(可逆)的BTK抑制劑,可在低nM水平下抑制野生型和BTK C481S突變體。
該研究共納入725例患者,其中RT隊(duì)列共57例患者。結(jié)果顯示,在可評估療效的50例患者中,ORR為54%(95% CI:39-68),包括5例完全緩解(CR)和22例部分緩解(PR)。中位隨訪時(shí)間為5.5個(gè)月時(shí)的中位DOR為8.6個(gè)月(95% CI,1.9-NE),中位隨訪時(shí)間為9.7個(gè)月時(shí)的中位OS為13.1個(gè)月(95% CI,7.1-NE)。在整個(gè)研究中,最常見的TEAE是疲勞(26%)、腹瀉(22%)和挫傷(19%),最常見的≥3級的TEAE是中性粒細(xì)胞計(jì)數(shù)減少 (20%)。
▌pirtobrutinib單藥治療華氏巨球蛋白血癥
禮來本次還展示了BRUIN研究中華氏巨球蛋白血癥(WM)隊(duì)列的結(jié)果。WM隊(duì)列共78例患者。結(jié)果顯示,在可評估療效的72例患者中,ORR為68%(95% CI,56-79),包括17例VGPR和32例PR。中位隨訪時(shí)間為7.7個(gè)月時(shí),49例患者的中位DOR未達(dá)到(95% CI,10-NE)。6個(gè)月的估計(jì)DOR率為86%(95% CI,69-94)。本次強(qiáng)生公布的是一項(xiàng)II期研究的數(shù)據(jù)。該研究是一項(xiàng)多中心、開放標(biāo)簽、單臂的臨床試驗(yàn)。截2022年5月25日,共納入44例患者,旨在評估伊布替尼治療復(fù)發(fā)性毛細(xì)胞白血病(HCL)患者的療效。
結(jié)果顯示,在42例可評估療效的患者中,第32周時(shí)的ORR為29%,第48周時(shí)提高到41%(18/44)。未達(dá)到中位PFS和OS。估計(jì)的60個(gè)月的PFS和OS分別為68%(95% CI:50%-81%)和87%(95% CI:71%-94%)。最常見的AE是腹瀉(59%)、疲勞(52%)、肌痛(52%)、惡心(48%)、血小板計(jì)數(shù)減少(45%)、上呼吸道感染(45 %)、瘀傷(41%)、咳嗽(41%)、頭痛(41%)和高血壓(41%)。
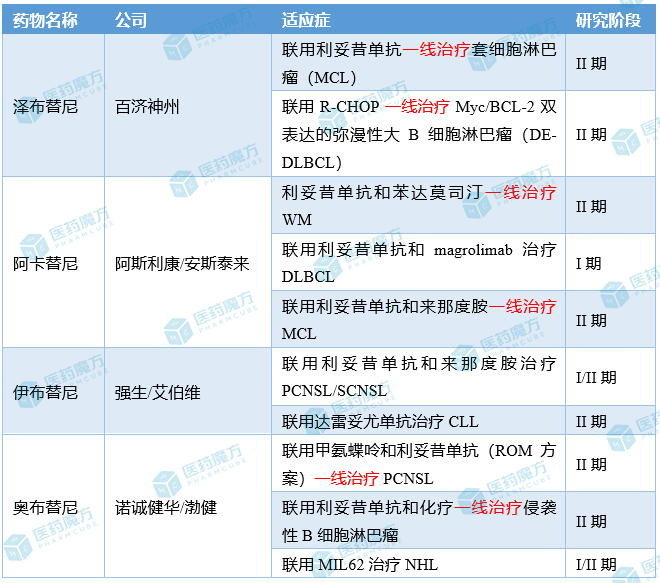
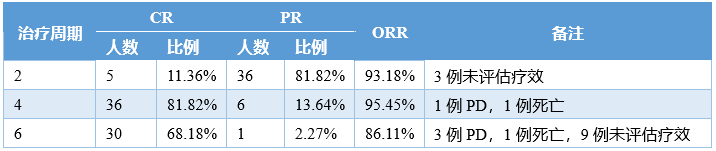
▌澤布替尼聯(lián)用利妥昔單抗(ZR方案)治療MCLCHESS–Chemo-less是一項(xiàng)開放標(biāo)簽的單臂II期臨床試驗(yàn),在2020年10月-2022年4月期間,共納入17例初診MCL患者。患者在接受ZR方案后需接受R-DHAOx方案(利妥昔單抗、地塞米松、阿糖胞苷和奧沙利鉑)治療,隨后接受澤布替尼維持治療。結(jié)果顯示,接受4個(gè)周期的ZR方案治療后,患者的CR率為88.2%,且所有患者均對治療產(chǎn)生反應(yīng)。治療期間的最佳CR率為94.1%。接受5個(gè)周期的ZR方案治療后患者疾病進(jìn)展,無進(jìn)展生存期為4.03個(gè)月。ZR方案的3-4級AE是中性粒細(xì)胞計(jì)數(shù)減少 (n=1) 和疲勞 (n=2)。最常見的1-2級AE是皮疹(17.6%)、中性粒細(xì)胞減少(17.6%)和皮下出血(17.6%)。未報(bào)告3-4 級房顫或出血。在化療期間,76.9%的患者出現(xiàn)3-4級血小板計(jì)數(shù)減少。▌澤布替尼聯(lián)用R-CHOP治療DE-DLBCLDE-DLBCL患者通常對R-CHOP(利妥昔單抗、環(huán)磷酰胺、多柔比星、長春新堿、潑尼松)反應(yīng)不佳,其長期生存率僅為30%-40%。有研究表明,伊布替尼可改善年輕DE-DLBCL患者的無事件生存期(EFS)和OS,但老年患者因耐受性較差無法從中獲益。鑒于澤布替尼可能有更好的安全性,百濟(jì)神州在一項(xiàng)II期研究中評估了澤布替尼聯(lián)用R-CHOP一線治療DE-DLBCL患者的療效和安全性。截至2022年7月20日,共44例患者完成了4個(gè)周期化療,36例患者完成了6個(gè)周期化療,具體療效數(shù)據(jù)如下:顯然,6個(gè)周期的澤布替尼聯(lián)用R-CHOP的療效明顯高于既往研究中單用R-CHOP(86.11% vs 70%)的療效。此外,6個(gè)月的PFS率為97.4%,12個(gè)月的PFS率為85%。百濟(jì)神州還另外開展了一項(xiàng)針對老年DLBCL(非GCB亞型)患者的II期研究(n=26)。在16例可評估療效的患者中,ORR為93.8%,CR率為62.5%。
▌阿卡替尼聯(lián)用利妥昔單抗和苯達(dá)莫司汀一線治療WMBrawm是一項(xiàng)非隨機(jī)的單臂II期臨床試驗(yàn),目前共納入10例患者。根據(jù)IPSS-WM評分系統(tǒng),1例患者為低危,1例為中危,8例為高危。IgM的中位數(shù)為28.5,除2例患者外,其他患者均在第6周期治療前將其IgM標(biāo)準(zhǔn)化(1例患者未完成第6周期評估)。對8例完成BR周期的患者進(jìn)行了5個(gè)月的中位隨訪,在第7個(gè)周期時(shí)均獲得了非常好的PR。目前還沒有患者出現(xiàn)疾病復(fù)發(fā)或進(jìn)展。將在第7、12和18個(gè)月對所有患者進(jìn)行微小殘留病分析。安全性方面,所有患者都發(fā)生了AE,但3級和4級AE的發(fā)生率僅為9.2%和1.7%。最常見的3-4級AE是血細(xì)胞減少,占3-4級事件的61.5%。沒有報(bào)告貧血、繼發(fā)性惡性腫瘤、肝毒性事件或死亡事件。單一停藥事件是由于3級房顫、2級心包積液和心包炎的并發(fā),這些都可能與阿卡替尼相關(guān)。▌阿卡替尼聯(lián)用利妥昔單抗和magrolimab治療DLBCLPRISM是一項(xiàng)非隨機(jī)、開放標(biāo)簽的I期臨床試驗(yàn),共納入7例DLBCL患者(截至 2021年3月31日)。結(jié)果顯示,ORR為28.6%(2/7),且均為CR。中位隨訪時(shí)間為8.3個(gè)月時(shí),這2例患者的DOR分別為0.03個(gè)月和7.36個(gè)月。最常見的(≥10%)≥3級的AE包括貧血(42.9%)、血小板減少(28.6%)、膽紅素升高(14.3%)、嘔吐(14.3%)和ALT升高(14.3%)。2例患者經(jīng)歷了嚴(yán)重的AE(1例肺炎,1例感染性休克)。總體而言,安全性與magrolimab 的既往單藥治療研究一致。▌阿卡替尼聯(lián)用利妥昔單抗和來那度胺治療MCL阿斯利康曾評估利妥昔單抗聯(lián)用來那度胺一線治療MCL患者的療效,此次公布的是阿卡替尼聯(lián)用利妥昔單抗和來那度胺一線治療MCL的II期研究結(jié)果。
該研究共納入24例患者(2019.10-2021.10),主要療效終點(diǎn)為MRD陰性且實(shí)現(xiàn)CR的患者比例。截至2022年7月,21例完成了12個(gè)周期的治療,11例完成了24個(gè)周期的治療。在可評估療效的21例患者中,ORR為100%,12個(gè)治療周期時(shí)的CR率為90.5%。此外,12個(gè)治療周期時(shí)的外周血MRD陰性的患者比例為71%(15/21),24個(gè)治療周期時(shí)這一比例為82%(9/11)。▌伊布替尼聯(lián)用利妥昔單抗和來那度胺治療PCNSL/SCNSL原發(fā)性中樞神經(jīng)系統(tǒng)淋巴瘤(PCNSL)是一種侵襲性原發(fā)性腦腫瘤。此前研究表明,單藥依魯替尼對復(fù)發(fā)性/難治性(r/r PCNSL)和繼發(fā)性中樞神經(jīng)系統(tǒng)淋巴瘤 (r/r SCNSL) 有效。本項(xiàng)研究將評估伊布替尼聯(lián)用來那度胺和利妥昔單抗的療效。該研究預(yù)計(jì)納入33例患者,目前可評估療效的患者共25例。在中位隨訪27個(gè)月后,80%(20/25)的患者疾病緩解,包括9例完全緩解,11例部分緩解,1例疾病穩(wěn)定,4例疾病進(jìn)展。達(dá)到最佳緩解的中位時(shí)間為60天;中位PFS為4.3個(gè)月,6個(gè)月時(shí)的PFS為42%,12個(gè)月時(shí)的PFS為37%;尚未達(dá)到中位OS。相比于難治性患者,復(fù)發(fā)性患者的中位PFS更好(未達(dá)到vs2.3個(gè)月);相比未接受自體干細(xì)胞移植(ASCT)的患者,先前接受ASCT的患者中位PFS較差(未達(dá)到vs9.6個(gè)月)。▌伊布替尼聯(lián)用達(dá)雷妥尤單抗治療CLLIDA53是一項(xiàng)非隨機(jī)、開放標(biāo)簽、單臂II期臨床試驗(yàn),共納入29例患者(2018年12月-2022年5月期間),主要終點(diǎn)為治療12個(gè)月時(shí)的CR率。由于入組人數(shù)未達(dá)預(yù)期以及未能達(dá)到主要終點(diǎn),該研究已提前結(jié)束。截至2022年7月18日,21例患者接受了12個(gè)月的治療(包括1例CR和20例PR),15例患者仍在接受治療。意向性治療人群的總體ORR和CR率分別為78%和3.7%。在中位隨訪時(shí)間為20.2個(gè)月時(shí),中位PFS和OS分別為27.1和33.5個(gè)月。安全性方面,≥3級AE為血液學(xué)(n=9)、感染(n=7)、代謝紊亂(n=5)等。≥10%的1-2級AE包括胃腸道疾病 (n=16)、代謝紊亂 (n=10)、心血管疾病 (n=7)、皮膚腫瘤 (n=6)、耳鼻喉感染 (n=5)、COVID-19 (n=5)、出血 (n=4) 和皮膚病 (n=3)。沒有發(fā)生腫瘤溶解綜合征。▌奧布替尼聯(lián)用甲氨蝶呤和利妥昔單抗(ROM方案)治療PCNSL針對PCNSL(屬于DLBCL的一種),諾誠健華也評估了奧布替尼聯(lián)合療法的療效。本次公布的是一項(xiàng)單臂II期研究的結(jié)果。在2021.07-2022.05期間,該試驗(yàn)共入組10例患者(病理為DLBCL),旨在評估ROM方案一線治療PCNSL患者的療效和安全性。結(jié)果顯示,5例患者(50%)實(shí)現(xiàn)了完全代謝緩解(CMR),5例實(shí)現(xiàn)了PR,誘導(dǎo)治療的ORR為100%。未達(dá)到中位PFS和OS。
▌奧布替尼聯(lián)用利妥昔單抗和化療治療侵襲性B細(xì)胞淋巴瘤
諾誠健華還公布了另一項(xiàng)II期研究的數(shù)據(jù)。2020年10月-2022年5月期間,共納入42例新診斷的侵襲性B細(xì)胞淋巴瘤患者,其中包括28例DLBCL,12例PCNSL,2例高級別B細(xì)胞淋巴瘤(HGBCL)。
在DLBCL和HGBCL患者中,有21例完成了6個(gè)周期的治療,ORR為100%,CR率為71.4%。估計(jì)的1年OS率和1年P(guān)FS率分別為100%和94.1%。此外,在非GCB-DLBCL亞組(n=17)中,CR率為84.5%。在PCNSL患者中,有7例患者完成了6個(gè)周期的治療,ORR為100%,4例患者達(dá)到CR。
42例患者均可進(jìn)行毒性評價(jià)。毒性反應(yīng)相對輕微,其中3級發(fā)熱性中性粒細(xì)胞減少2例(4.8%),3級中性粒細(xì)胞減少(2.4%),3級血小板減少(2.4%),3級白細(xì)胞減少(2.4%)。沒有報(bào)告其他3-4級非血液學(xué)AE。沒有因AE引起的劑量調(diào)整。
本次公布的是一項(xiàng)I/IIa期研究的結(jié)果。該研究是一項(xiàng)開放標(biāo)簽的單臂臨床試驗(yàn),共納入43例患者,旨在評估奧布替尼聯(lián)用MIL62治療復(fù)發(fā)性或難治性非霍奇金淋巴瘤(NHL)患者的療效和安全性。MIL62是天廣實(shí)和恒瑞合作開發(fā)的一款CD20單抗,目前處于III期研究階段。
截至2022年7月15日,在可評估療效的42例患者中,ORR為64.3%,包括13例CR和14例PR。此外,在DLBCL亞組(n=30)中,ORR為56.7%,包括7例CR和10例PR。中位PFS為5.8個(gè)月,9個(gè)月的ORR為71.4%,12個(gè)月的OS率為73.0%。此外,在20例對利妥昔單抗耐藥的患者中,有10例患者實(shí)現(xiàn)客觀緩解,中位PFS為5.6個(gè)月。
在可評估安全性的43例患者中,發(fā)生治療緊急不良事件(TEAE)和治療相關(guān)不良事件(TRAE)的患者分別為39例(90.7%)和38例(88.4%)。20例(46.5%)患者出現(xiàn)3級或以上TEAE,其中16例(37.2%)患者出現(xiàn)TRAE,包括粒細(xì)胞減少(20.9%)和血小板減少(16.3%)。14例(32.6%)患者發(fā)生SAE,其中11例(25.6%)為TRAE。
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點(diǎn)。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時(shí)間刪除內(nèi)容