布魯頓酪氨酸激酶(BTK)是非受體型酪氨酸激酶TEC家族中的一員,參與B細(xì)胞的增殖、成熟、分化和凋亡的全過程。作為B細(xì)胞受體(BCR)信號傳導(dǎo)中的關(guān)鍵一環(huán),BTK早已成為治療B細(xì)胞惡性腫瘤的實力靶點。前有強生聯(lián)袂艾伯維入局控場,伊布替尼雄踞百億美元市場;后有阿斯利康持續(xù)發(fā)力,阿卡替尼踏入十億美元俱樂部;亦有百濟(jì)神州澤布替尼頭對頭挑戰(zhàn)“帶頭大哥”,出海故事持續(xù)演繹中。然而,強如伊布替尼,亦有硬傷——耐藥突變是所有共價型BTK抑制劑的痛點。共價抑制劑結(jié)合BTK的半胱氨酸481殘基(C481),發(fā)揮不可逆抑制BTK的抗腫瘤作用。長期用藥后,C481位點面臨突變風(fēng)險,絲氨酸取代半胱氨酸(C481S),抑制劑與BTK的作用模式由不可逆結(jié)合弱化為可逆結(jié)合,獲得性耐藥出現(xiàn)。此外,BCR信號通路下游的PLCγ2突變也令共價BTK抑制劑束手無策[1,2]。正是這些不完美,給后來者留存競爭空間。非共價BTK抑制劑是開發(fā)新一代BTK抑制劑的重要策略,有望解決耐藥突變的問題。它不依賴于與C481結(jié)合起效,而是形成氫鍵可逆性結(jié)合BTK蛋白,從而抑制BTK活性阻遏BCR信號傳導(dǎo)。禮來、羅氏和默沙東等巨頭紛紛投身于差異化BTK抑制劑的研發(fā),以期在這個百億美金的市場上擁有一席之地。禮來Pirtobrutinib:以一敵三的孤勇者
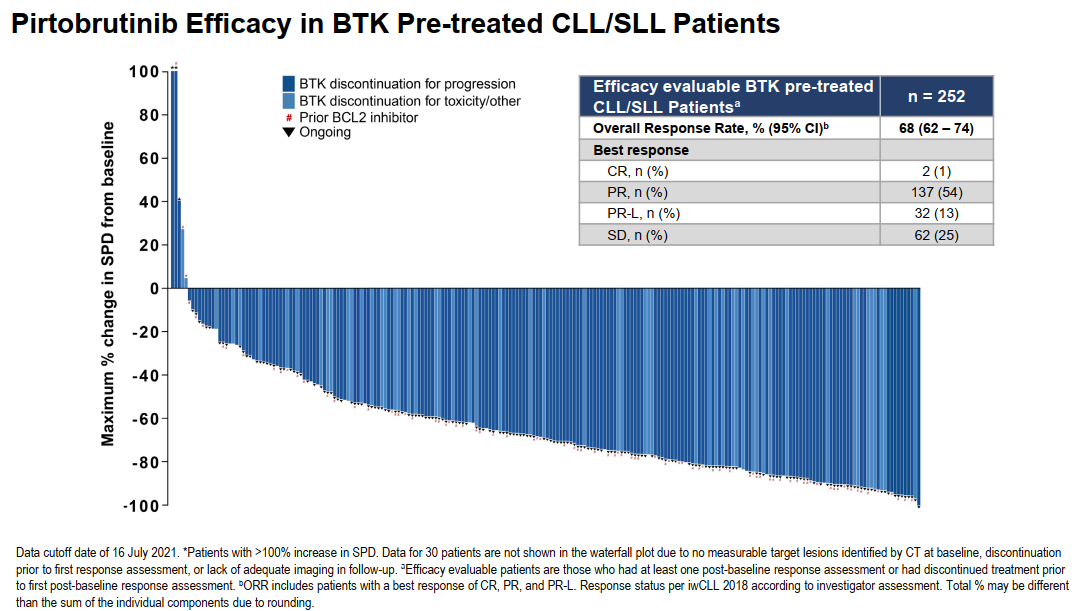
2020年12月,禮來公布了一項頭對頭III期研究計劃,聚焦Pirtobrutinib二線治療套細(xì)胞淋巴瘤(MCL)患者的有效性與安全性。頭對頭已屢見不鮮,然以一敵三的PK仍屬珍貴。這項正在進(jìn)行中的研究中,禮來一并將Pirtobrutinib與伊布替尼、阿卡替尼、澤布替尼三款共價BTK抑制劑進(jìn)行優(yōu)效性比較,雄心可見一斑。野心源自實力。2021年12月,Pirtobrutinib驚艷亮相美國血液學(xué)會(ASH)年會,向世人展示BRUIN研究的數(shù)據(jù)。這項龐大的I/II期研究共招募618例患者,其中大多數(shù)患者曾接受BTK抑制劑治療,后因疾病進(jìn)展或不耐受毒性而停藥。首先來看Pirtobrutinib單藥治療CLL/SLL的效果,在252例BTK抑制劑經(jīng)治的人群中(中位治療線數(shù)3),客觀緩解率(ORR)為68%。隨著時間戰(zhàn)線的拉長,Pirtobrutinib的反應(yīng)強度繼續(xù)加深,隨訪12個月以上時患者的ORR值上升至73%。探索性分析顯示,Pirtobrutinib在BTK C481突變型和野生型患者中具有相似的PFS獲益。這張令人印象深刻的瀑布圖,更能直觀地展現(xiàn)Pirtobrutinib的實力。禮來還在探究Pirtobrutinib聯(lián)合療法在復(fù)發(fā)或難治性CLL中的潛力。Pirtobrutinib與Bcl-2抑制劑Venetoclax的組合獲得了93.3%的ORR(14/15),接受Pirtobrutinib聯(lián)合Venetoclax與利妥昔單抗治療的7例可評估患者全部實現(xiàn)部分緩解,ORR達(dá)到100%。
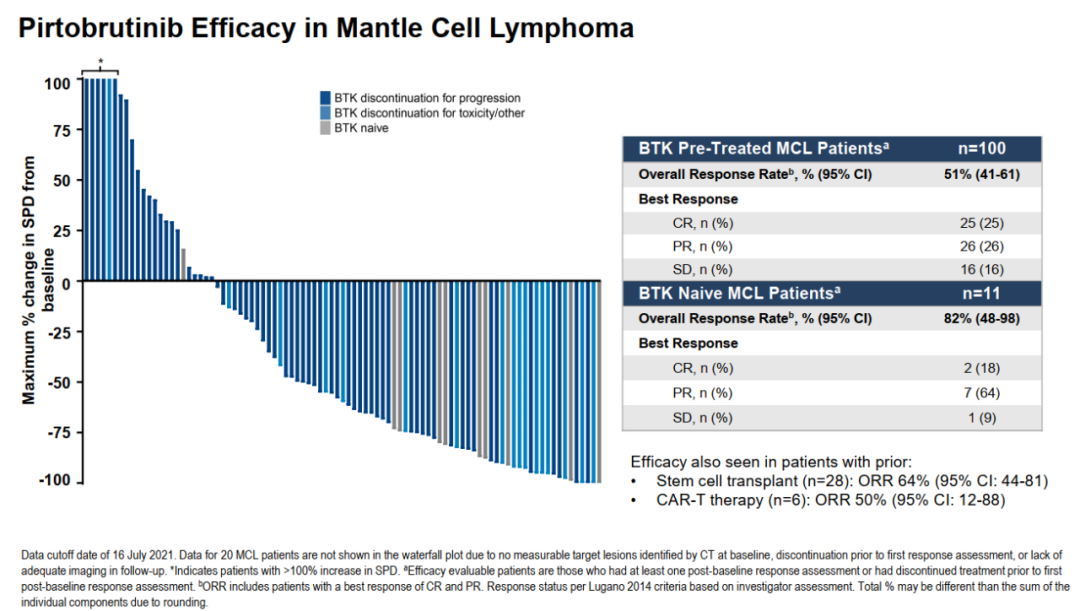
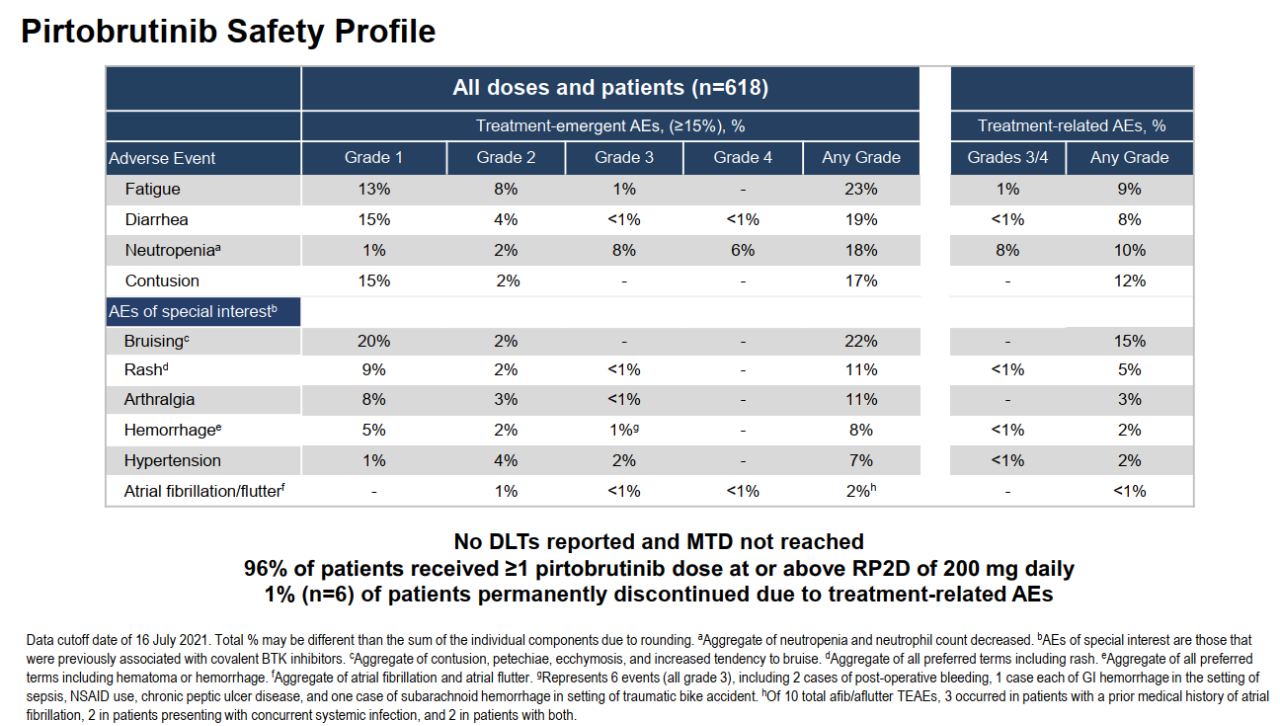
在MCL中,Pirtobrutinib的表現(xiàn)同樣不俗。在100例有BTK抑制劑治療史的可評估患者群體中,ORR實現(xiàn)51%;針對11例BTK抑制劑初治的患者,ORR達(dá)82%。中位緩解時間也達(dá)到了18個月。Pirtobrutinib的安全性良好,出血和房顫的發(fā)生率低,分別為8%和2%。劑量遞增階段,爬坡至200mg未出現(xiàn)劑量限制性毒性,也沒有達(dá)到最大耐受劑量。僅有1%的患者因治療相關(guān)的不良反應(yīng)而永久停藥。
同年12月,禮來宣布開始向FDA滾動提交Pirtobrutinib的上市申請,適用于既往接受過BTK抑制劑治療的MCL患者。這與強生等多數(shù)玩家的開發(fā)策略相同,從MCL切入逐步拓寬BTK抑制劑的應(yīng)用范圍。之后,禮來披露FDA已授予該項上市申請優(yōu)先審評。今時,Pirtobrutinib在禮來手中大放異彩;彼時,也曾經(jīng)歷多次輾轉(zhuǎn)。Pirtobrutinib原名RXC005,最早由Redx Pharma研發(fā),2017年公司瀕臨破產(chǎn),無奈以4000萬美元的價格出售RXC005的全部權(quán)益。Loxo Oncology則是那個眼光獨到的買主,RXC005隨之更名為LOXO-305。2019年初,禮來80億美元現(xiàn)金收購了Loxo Oncology,囊獲Pirtobrutinib在內(nèi)的一系列腫瘤新藥。今年,禮來與信達(dá)生物深化合作,后者收獲Pirtobrutinib未來在中國大陸商業(yè)化權(quán)利的優(yōu)先談判權(quán),可見實力者從不乏擁躉。默沙東Nemtabrutinib:珠玉在前,如何突圍?
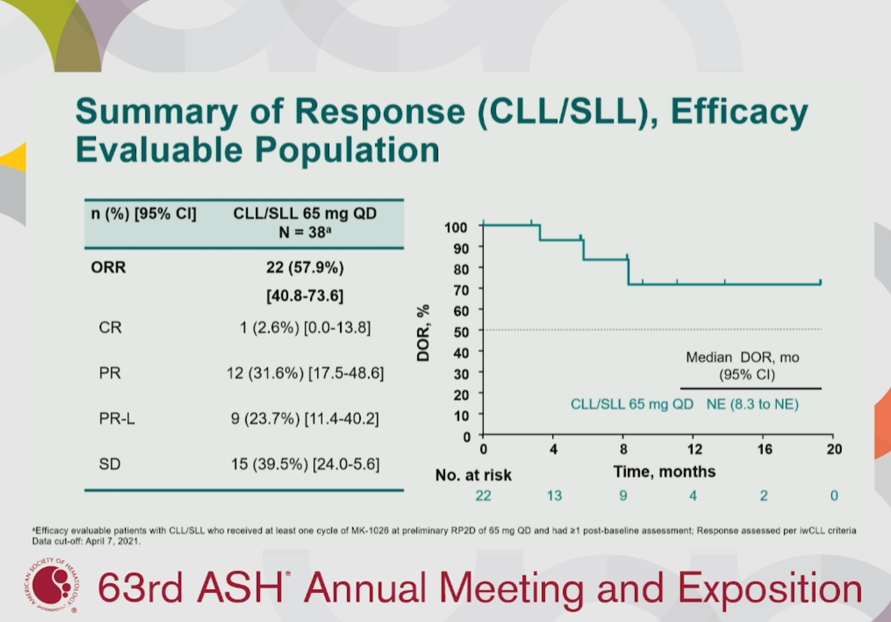
無獨有偶。2019年末,默沙東同樣通過收購的方式加入了BTK領(lǐng)域的競賽中,交易總額為27億美金。被收購方ArQule的核心資產(chǎn)ARQ 531是一款可逆的非共價型BTK抑制劑。ARQ 531競爭性占據(jù)BTK的ATP結(jié)合口袋,不與C481相互作用[3],因此既能抑制野生型也能阻抑突變型BTK。ARQ 531如今名曰Nemtabrutinib,又稱MK-1026,與Pirtobrutinib同屬于非共價抑制劑范疇,但又蘊藏著極大的不同。Nemtabrutinib擁有相似于伊布替尼的母核結(jié)構(gòu),故繼承了其多靶點抑制的特性,對TEK家族、Trk家族和Src家族激酶均有作用。這或許能帶來強有力的協(xié)同抑制BCR信號傳導(dǎo)的效應(yīng),但也可能埋下安全性隱患。2021年的ASH大會也記錄了Nemtabrutinib的積極數(shù)據(jù)。前期的劑量遞增試驗敲定了65mg每日1次(65mg QD)作為Nemtabrutinib的II期臨床試驗推薦劑量。51例CLL/SLL患者參與了II期劑量擴(kuò)展研究, 84%的患者之前接受過BTK抑制劑治療,63%攜帶C481S BTK突變。38例療效可評估患者的ORR為58%,其中1例完全緩解,12例部分緩解,9例為伴淋巴細(xì)胞升高的部分緩解。安全性方面,所有118例患者中,Nemtabrutinib治療相關(guān)的不良反應(yīng)發(fā)生率為66%,8%的患者由于藥物相關(guān)的不良反應(yīng)停藥。珠玉在前,后來者的壓力不小。默沙東表示將繼續(xù)評估65mg和更高劑量的Nemtabrutinib在血液系統(tǒng)惡性腫瘤人群中的藥效。聯(lián)合應(yīng)用也是默沙東的開發(fā)方向之一,靶向ROR1的抗體偶聯(lián)藥物Zilovertamab vedotin聯(lián)合Nemtabrutinib的II期研究處于招募階段。CLL/SLL向來是BTK抑制劑的必爭之地。伊布替尼的問世打開了CLL/SLL口服靶向治療的大門。憑借III期RESONATE-2研究中顯著優(yōu)于化療藥物的療效(ORR:82.4% vs 35.3%),于2016年獲得FDA點頭,成功推進(jìn)至CLL/SLL的一線治療,同時也得到了美國NCCN指南推薦。2019年,阿卡替尼突破一線CLL/SLL的防線,銷售額飆升。雖然阿卡替尼難以撼動伊布替尼No.1的地位,卻也實實在在地攫取了市場份額。澤布替尼亦對伊布替尼造成了一定的沖擊。源于安全性問題,伊布替尼在2023 V1 NCCN指南中從CLL/SLL一線和二線的首選治療方案轉(zhuǎn)移到其他推薦方案。另一方面,澤布替尼躋身一線治療CLL/SLL首選推薦行列。ALPINE研究也為澤布替尼的實力加碼,澤布替尼在治療復(fù)發(fā)或難治性CLL/SLL中彰顯出優(yōu)于伊布替尼的ORR(78.3% vs 62.5%)。目前,百濟(jì)神州正在等待FDA審評澤布替尼治療CLL/SLL的最終決議。如今,在血液瘤領(lǐng)域,無論是共價還是非共價BTK抑制劑,競爭格局都已經(jīng)顯現(xiàn)。若想在BTK賽道異軍突起,實屬難事但也非毫無勝算。羅氏Fenebrutinib:另辟蹊徑,或有可為
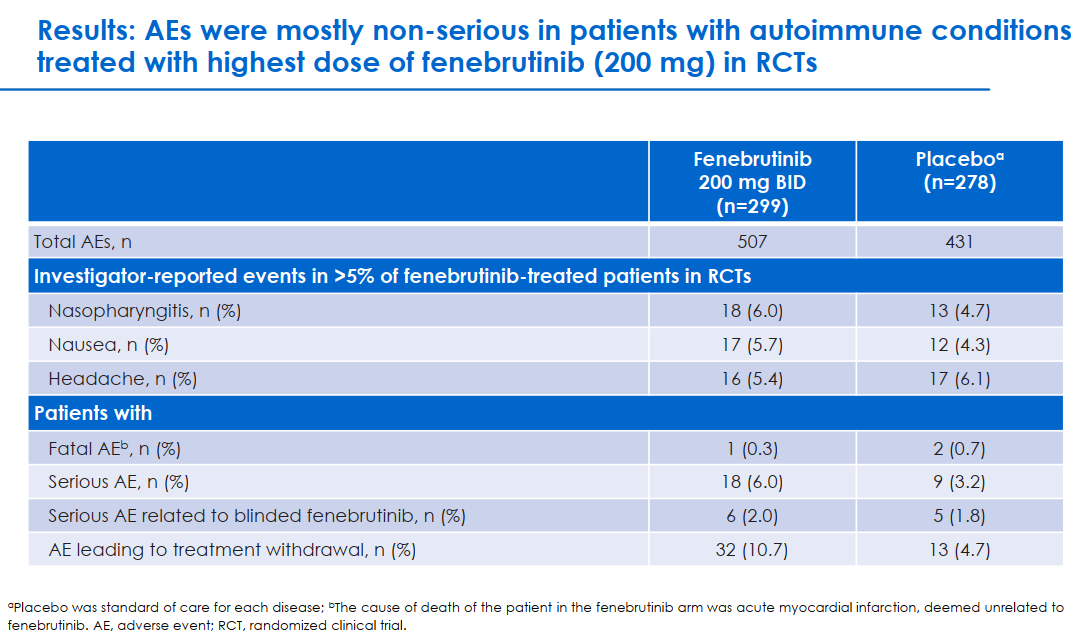
面對血液瘤領(lǐng)域的BTK角逐,羅氏和賽諾菲就將目光轉(zhuǎn)向存在更多未竟臨床需求的自身免疫性疾病,包括多發(fā)性硬化癥、系統(tǒng)性紅斑狼瘡和類風(fēng)濕性關(guān)節(jié)炎等。多發(fā)性硬化癥(MS)是一種免疫介導(dǎo)的中樞神經(jīng)系統(tǒng)炎性脫髓鞘疾病,異常激活的T細(xì)胞、B細(xì)胞以及髓性細(xì)胞都在MS的病理機(jī)制中扮演著重要角色。BTK是B細(xì)胞和骨髓細(xì)胞中的關(guān)鍵信號傳導(dǎo)的元件,故而BTK可作為治療MS的潛力靶標(biāo)。羅氏開發(fā)的Fenebrutinib(RG7845,GDC-0853)是一款高選擇性的可逆型BTK抑制劑,也是全球唯一躍進(jìn)III期MS研究的非共價BTK抑制劑。該藥物不僅可與BTK較長時間結(jié)合來模擬共價抑制劑的持久抑制作用,還有可能打破脫靶毒性的限制,獲得更佳的安全性。此外,雙重作用機(jī)制也是Fenebrutinib的獨特優(yōu)勢,它能夠同時抑制血液中的B細(xì)胞和髓系細(xì)胞的激活,有潛力減輕MS誘發(fā)的急性和慢性炎癥。2020年,羅氏宣布將啟動Fenebrutinib的III期臨床項目,包含1項FENtrepid研究和2項相同的FENhance 1/2研究。FENtrepid研究頗受矚目,將Fenebrutinib與Ocrelizumab在946例原發(fā)進(jìn)展型多發(fā)性硬化癥患者中進(jìn)行頭對頭比較,后者是首個獲批用于治療原發(fā)進(jìn)展型(PPMS)和復(fù)發(fā)緩解型多發(fā)性硬化癥(RRMS)兩種疾病類型的藥物。FENhance 1/2研究分別針對736例復(fù)發(fā)型多發(fā)性硬化癥(RMS)患者,意在比較Fenebrutinib與賽諾菲Teriflunomide的有效性與安全性。Fenebrutinib并非開始就錨定MS領(lǐng)域,此前已經(jīng)歷了B細(xì)胞淋巴瘤、類風(fēng)濕性關(guān)節(jié)炎、系統(tǒng)性紅斑狼瘡、自發(fā)性蕁麻疹等多項適應(yīng)癥的探索。這也為Fenebrutinib的安全性提供了參考:在隨機(jī)對照試驗(n = 299)中,沒有患者出現(xiàn)房顫或大出血的情況,接受Fenebrutinib治療的患者發(fā)生嚴(yán)重不良反應(yīng)的概率為6%。無癥狀且可逆的肝臟轉(zhuǎn)氨酶升高是與Fenebrutinib有因果關(guān)系的唯一風(fēng)險。賽諾菲的探索就顯得略有悲情。2020年,賽諾菲斥資36.8億美元收購獲得了兩款在研的共價不可逆BTK抑制劑Rilzabrutinib和Tolebrutinib,卻遭受接連失利。2021年,Rilzabrutinib治療自免疾病天皰瘡的III期研究以未達(dá)到其主要或關(guān)鍵次要終點收場。今年,鑒于數(shù)例藥物相關(guān)的肝損傷比例,Tolebrutinib針對MS和重癥肌無力的III期研究遭FDA部分暫停。默克和諾誠健華也在嘗試將共價不可逆BTK抑制劑應(yīng)用于MS的治療。在一項II期研究中,默克的Evobrutinib被證實為RMS患者提供了超過3年半的持續(xù)臨床獲益。諾誠健華則將奧布替尼治療MS的全球權(quán)益授予渤健,其正在開展涵蓋中美歐的II期研究。總結(jié)
從現(xiàn)有的臨床數(shù)據(jù)看,Pirtobrutinib在血液惡性腫瘤方面的表現(xiàn)較Nemtabrutinib更勝一籌,不過現(xiàn)在仍是乾坤未定。羅氏避開鋒芒,選擇BTK抑制劑尚未成功開拓的MS領(lǐng)域,也不失為明智之舉。藥物的迭代開發(fā)總有說不完的故事,尤其是BTK這一黃金賽道有多少玩家趨之若鶩,也涌現(xiàn)了不少差異化的新秀產(chǎn)品值得我們關(guān)注。BTK C481S抑制劑是否能真正攻克安全性和耐藥問題,做到療效與安全的最優(yōu)解且交給時間驗證。
[1] Bond DA, Woyach JA. Targeting BTK in CLL: Beyond Ibrutinib[J]. Curr Hematol Malig Rep, 2019, 14(3): 197-205.
[2] Woyach JA, Furman RR, et al. Resistance Mechanisms for the Bruton’s Tyrosine Kinase Inhibitor Ibrutinib[J]. N Engl J Med, 2014, 370(24): 2286-2294.
[3] Reiff SD, Mantel R, et al. The BTK Inhibitor ARQ 531 Targets Ibrutinib Resistant CLL and Richter’s Transformation[J]. Cancer Discov, 2018, 8(10): 1300-1315.
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容