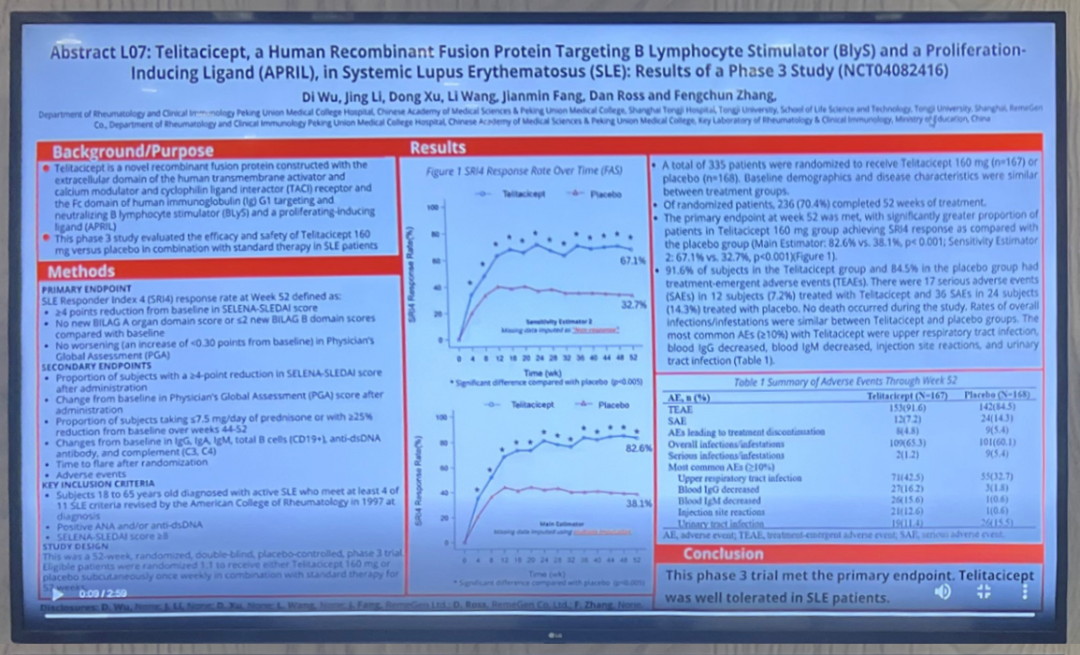
當地時間11月14日下午,2022年美國風濕病學會年會(American College of Rheumatology,ACR)的線下會場,一項重磅研究引發廣泛關注——榮昌生物制藥(煙臺)股份有限公司以重要壁報形式公布了泰它西普治療系統性紅斑狼瘡的國內Ⅲ期臨床研究。美國風濕病學會(ACR)成立于1934年,是一個非營利性、全球醫學協會。作為世界規模最大、最負盛名的風濕學會議,ACR年會匯聚了最新的研究成果和最具影響力的演講嘉賓,每年都會吸引全球100多個國家約16000余名代表參與,已成為醫學人士獲取最前沿風濕病學研究與臨床應用信息的重要平臺。本屆年會上,評分前10%的壁報可被納入“熱力演講”(Ignite talk)環節,而泰它西普就是其中之一。會上,榮昌生物全球商務拓展高級副總裁Dan Ross代表公司發表演講并參與現場討論。Dan Ross介紹了,由北京協和醫院張奉春教授牽頭完成的泰它西普治療系統性紅斑狼瘡(SLE) 患者的國內Ⅲ期確證性研究情況。短短五分鐘的匯報,吸引了與會專家及國際媒體的目光,大家紛紛駐足交流,對泰它西普的全球開發計劃表示出極大興趣。這不是泰它西普首次亮相美國風濕病學會(ACR)年會。2019年12月5日,泰它西普治療系統性紅斑狼瘡的關鍵臨床研究作為“最新突破性進展”在ACR大會萬人主會場作口頭報告,成為當年大會的重磅消息,也是ACR大會歷史上中國原創新藥第一次獲此殊榮,引起國際業界強烈反響。此次亮相的泰它西普國內Ⅲ期確證性研究是一項多中心、隨機、雙盲、安慰劑對照的臨床研究,共入組335例SLE患者,患者隨機分配到泰它西普(160毫克)組或安慰劑組,每周皮下注射一次,與標準治療相結合,為期52周。初步結果顯示,本研究達到了預設的臨床終點,第52周SRI-4應答率在泰它西普組為82.6%,安慰劑組為38.1%,泰它西普組的SRI-4反應率均明顯高于安慰劑組,顯示出了良好的安全性和耐受性。目前,泰它西普治療系統性紅斑狼瘡患者的全球多中心Ⅲ期臨床試驗正在順利推進,已于今年上半年在美國完成首例受試者入組給藥。泰它西普是由公司CEO、首席科學官房健民教授發明設計的一個抗體融合蛋白藥物分子,通過同時抑制BLyS和APRIL兩個細胞因子的過度表達,“雙管齊下”阻止B細胞的異常分化和成熟,從而治療B細胞介導的系統性紅斑狼瘡等一系列自身免疫性疾病。2021年3月9日,泰它西普系統性紅斑狼瘡適應癥正式獲得國家藥監局的國內上市批準,同年底進入國家醫保藥品目錄。除系統性紅斑狼瘡適應癥外,泰它西普治療類風濕性關節炎、IgA腎炎、原發性干燥綜合征、視神經脊髓炎譜系疾病、重癥肌無力、多發性硬化等適應癥的Ⅲ期臨床研究也在推進中。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容