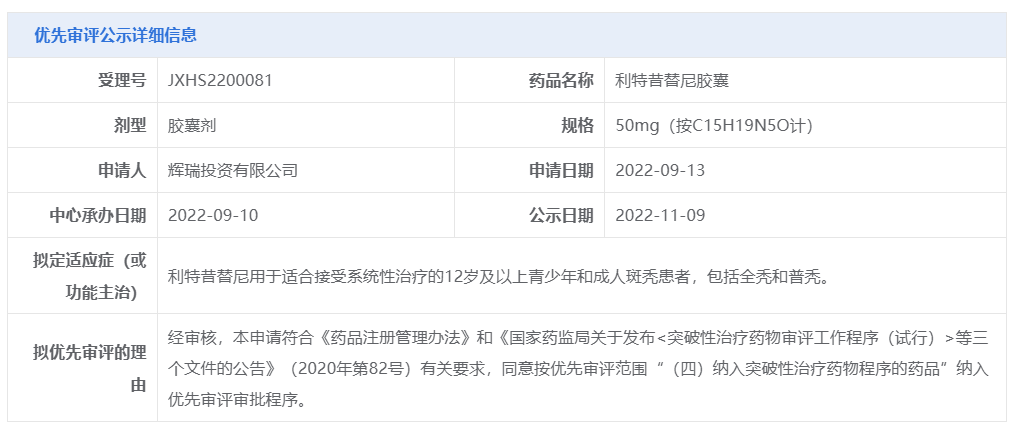
11月9日,CDE官網(wǎng)顯示,輝瑞的利特昔替尼膠囊(ritlecitinib)上市申請擬納入優(yōu)先審評,用于適合接受系統(tǒng)性治療的12歲及以上青少年和成人斑禿患者,包括全禿和普禿。此前,該適應癥曾獲CDE突破性療法認定。
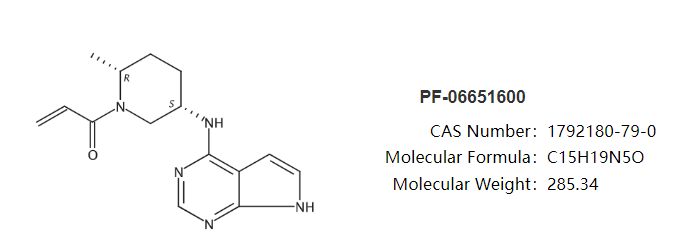
利特昔替尼是由輝瑞開發(fā)的一款新型口服靶向Janus激酶3(JAK3)抑制劑。研究證明,利特昔替尼可阻斷信號分子和免疫細胞活性,而這些信號分子和免疫細胞被認為是導致斑禿的原因。與第一代泛JAK抑制劑相比,利特昔替尼在降低毒性方面更有優(yōu)勢。今年9月,利特昔替尼治療斑禿的上市申請相繼獲美國FDA和歐洲EMA受理,預計分別在2023年第二季度、第四季度作出監(jiān)管決定。該藥在歐美的上市申請是基于既往公布的IIb/III期ALLEGRO研究和正在進行的III期ALLEGRO- LT長期研究的結果。ALLEGRO是一項隨機、雙盲、安慰劑對照、IIb/III期研究,旨在評估ritlecitinib治療12歲及以上斑禿患者(n=718)的療效和安全性。入組患者至少有50%的頭發(fā)因斑禿而脫落,包括全禿(頭發(fā)全部脫落)和普禿(全身毛發(fā)均脫落)患者,并且已持續(xù)6個月至10年的斑禿發(fā)作。患者隨機接受每日1次ritlecitinib 30mg或50mg(接受或不接受1個月的初始治療:每日1次ritlecitinib 200mg)、ritlecitinib 10mg或安慰劑治療。主要終點為第24周時絕對SALT評分≤20,對ritlecitinib治療有反應的頭皮毛發(fā)再生患者比例。SALT是一種測量頭皮脫發(fā)量工具,評分越高,脫發(fā)越嚴重。結果顯示,每日服用30mg和50mg ritlecitinib治療的患者(無論是否接受為期4周的初始治療)在24周時,頭皮毛發(fā)覆蓋率≥80%的患者比例顯著高于安慰劑組。總的安全性數(shù)據(jù)表明,ritlecitinib在成人和青少年患者中耐受性良好。最常見的不良事件為頭痛、鼻咽炎和上呼吸道感染。ALLEGRO-LT是一項正在進行的開放標簽的、長期的III期研究,旨在評估ritlecitinib在脫發(fā)率為25%或以上的成人斑禿患者和脫發(fā)率為50%或以上的12歲青少年斑禿患者中的安全性和有效性。
聲明:本文系藥方舟轉載內(nèi)容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容