
2022-11-08 14:54:22來源:藥智網瀏覽量:483
導讀:乳腺癌“神藥”威力再顯。
近日,第一三共發布了二季度財報,其與阿斯利康合作的重磅ADC藥物Enhertu(DS-8201)上半年銷售額795億日元,約合5.68億美元(140日元兌1美元),更上調了全年業績,預測Enhertu 22年全球銷售額將達到1952億日元(13.93億美元)。
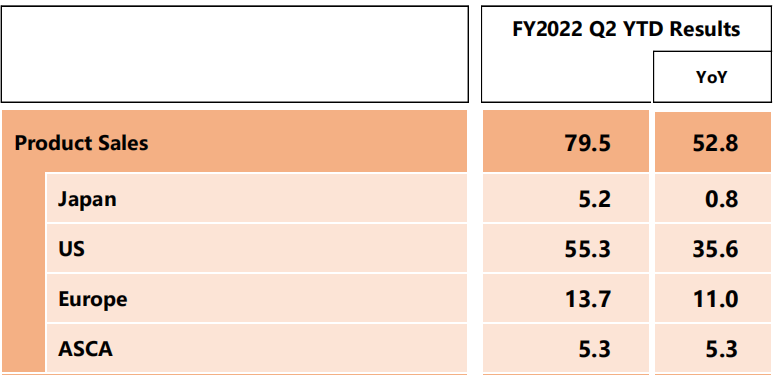
圖1 Enhertu的各地區銷售情況
來源:二季度報(十億日元)
據不完全統計,目前上市的14款ADC藥物中,只有Seagen/武田的Adcetris和羅氏的Kadcyla,在去年的全球銷售額超過10億美元。
Seagen/武田的Adcetris,突破10億美元的銷售大關,用時將近10年;羅氏Kadcyla則用了5年時間,而乳腺癌神藥Enhertu(DS-8201)或將僅僅只用兩年時間。
最快破$10億ADC藥物?乳腺癌“神藥”Enhertu究竟有何魅力,誰能與HER2 ADC一戰?
01 乳腺癌“神藥”威力再顯
Enhertu是阿斯利康和第一三共聯合開發的一款靶向HER2的抗體藥物偶聯物,通過一種4肽鏈接子將靶向HER2的人源化單克隆抗體trastuzumab(曲妥珠單抗)與一種新型拓撲異構酶1抑制劑exatecan衍生物(DX-8951衍生物,DXd)鏈接在一起,可靶向遞送細胞毒制劑至癌細胞內。
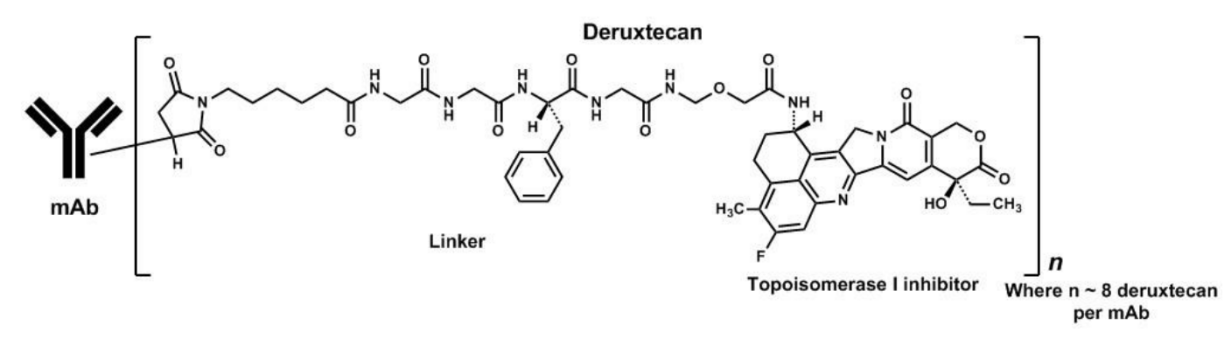
圖2 Enhertu的組成
來源:說明書
具備4大優點:
更高的載藥量:運用獨特的疏水性連接子與半胱氨酸殘基定點偶聯技術,降低了ADC的疏水性,T-DXd(Enhertu)每個抗體可以攜帶7-8個DXd分子。藥物與抗體比率(DAR)高于T-DM1(Kadcyla)的3-4。
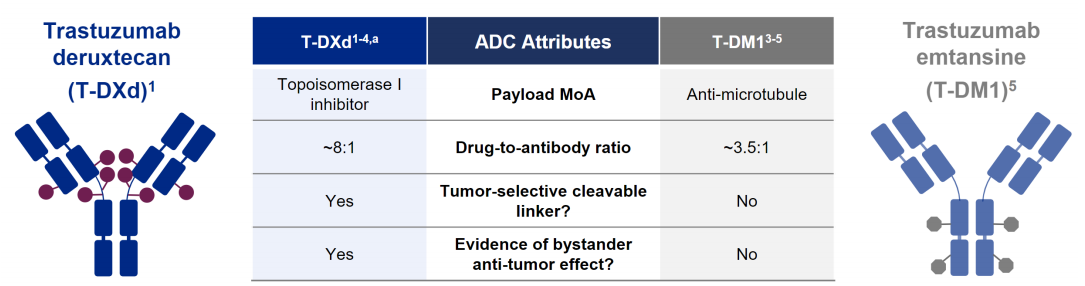
圖3 T-DXd相較于T-DM1的優勢
來源:華創證券
彈頭選擇:DXd與微管抑制劑相比,其毒性更強,半衰期更短,毒素在人體內存留的時間更短
linker設計:T-DXd的疏水性四肽linker可以被腫瘤細胞中高表達的溶酶體酶降解從而釋放DXd,并可避免藥物聚合。
另外,DXd具有較高的膜穿透性,釋放后的DXd可以穿透至鄰近腫瘤細胞,通過“旁觀者效應”發揮殺傷作用。
2019年3月,阿斯利康和第一三共簽訂全球合作開發和商業化協議,以首付款13.5億美元+潛在里程碑55.5億美元的金額大筆獲得Enhertu。
這次的交易總額達到69億美元,作為回報阿斯利康將與第一三共平等的分享日本以外的全球利潤,對阿斯利康來說這是其擴大腫瘤學影響的一場豪賭。
現在看來是值得。
三季報中提到隨著新適應癥的獲批以及市場滲透率增長,Enhertu銷售必將實現穩定增長。
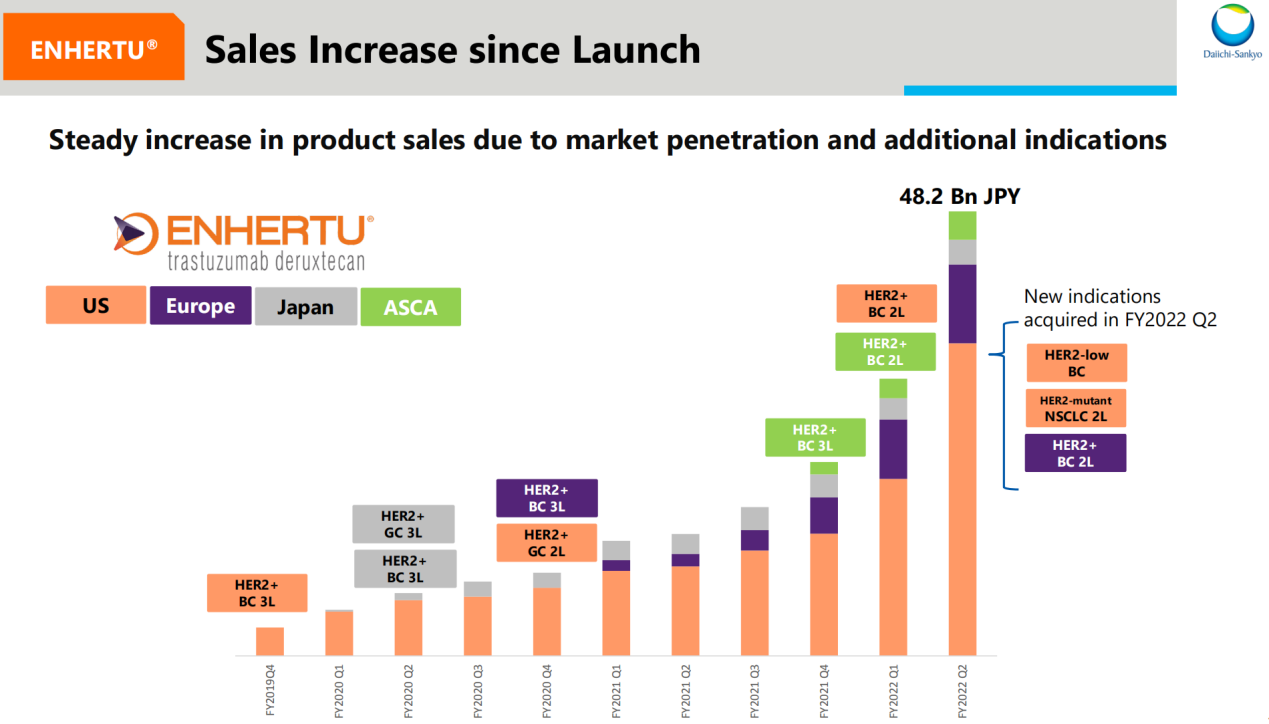
圖4 Enhertu適應癥獲批進度和主要地區銷售情況
來源:二季度報
乳腺癌
乳腺癌患者中根據癌細胞表達的受體類型可分為三類:HER2陽性、HR陽性/HER2陰性、和三陰性(ER-PR-HER2-)乳腺癌。
其中HER2陽性乳腺癌患者占比約20%,首選療法是HER2靶向治療,已有多款HER2靶向藥物獲批。
HER2陰性患者(約占80%)治療選擇相對有限,HER2低表達的乳腺癌患者占比約50%。
HER2陽性乳腺癌
2019年12月FDA批準Enhertu用于治療接受過2種或以上抗HER2療法治療的無法切除或轉移性HER2陽性乳腺癌患者。
Enhertu與大名鼎鼎的ADC藥物Kadcyla頭對頭試驗的基礎上被FDA獲批,根據發表在NEJM的研究顯示(DESTINY-Breast03),Enhertu vs Kadcyla的12個月PFS率為75.8%vs 34.1%;12個月OS率為94.1%vs 85.9%;Enhertu vs Kadcyla的ORR為79.7%vs 34.2%,可見Enhertu在頭對頭研究中展現出遠超Kadcyla的療效。
2022年5月FDA批準Enhertu用于治療無法切除或轉移性HER2陽性乳腺癌患者,這些患者曾經接受過一種抗HER2靶向療法的治療。
HER2低表達乳腺癌
2022年8月FDA批準Enhertu用于治療不可切除或轉移性HER2低表達(免疫組化[IHC]1+或2+/原位雜交[ISH]陰性)乳腺癌成人患者。
其中HER2低表達的乳腺癌患者占比約50%,治療手段有限以化療手段為主。Enhertu成為首個在HER2-low的人群中做出生存優勢的HER2靶向治療,這有望重新定義HER2-low乳腺癌治療。
FDA的批準是基于DESTINY-Breast04 III期試驗的結果。
在該試驗中,與醫生選擇的化療相比,Enhertu將激素受體陽性(HR+)或激素受體陰性(HR-)的HER2低表達轉移性乳腺癌患者的疾病進展或死亡風險降低了50%,PFS:9.9月對比5.1個月(HR:0.50;95%CI 0.40-0.63;p<0.0001)。接受Enhertu治療的患者的OS為23.4個月,而化療組為16.8個月,Enhertu與化療相比將死亡風險降低了36%(HR 0.64;95%CI 0.49-0.84;p=0.001).
胃癌
2021年1月FDA批準Enhertu用于治療HER2陽性轉移性胃或胃食管交界(GEJ)腺癌患者,是第一個被批準治療HER2陽性胃癌的ADC藥物。
Enhertu在美國和日本的胃癌適應癥批準,均基于開放標簽、隨機2期DESTINY-Gastric01試驗的結果。研究中,患者(先前接受過2種或多種方案(包括5-FU、含鉑化療、曲妥珠單抗)但病情進展)以2:1的比例隨機分配,接受Enhertu(6.4mg/kg)或研究調查員選擇的化療(紫杉醇或伊立替康單藥治療),每三周一次。結果顯示,Enhertu組的ORR為51.3%(95%CI:41.9-60.5%)、化療組為14.3%(95%CI:6.4-26.2%)。在一項預先指定的中期分析中,Enhertu組與化療組相比死亡風險降低41%(HR=0.59;95%CI:0.39-0.88;p=0.0097)。Enhertu組的中位OS為12.5個月、化療組為8.4個月。
肺癌
2022年8月,FDA批準Enhertu用于治療攜帶激活性HER2突變的無法切除或轉移性NSCLC患者。這也是FDA批準治療HER2突變NSCLC的首款藥物。加速批準的療效基于DESTINY-Lung02。患者(患有不可切除或轉移的HER2突變非鱗狀非小細胞肺癌,并在先前的全身治療后疾病進展)通過靜脈輸注接受Enhertu 5.4mg/kg,每3周一次,直到出現不可接受的毒性或疾病進展。試驗結果顯示客觀緩解率為58%,中位緩解持續時間為8.7個月。
02 誰能與Enhertu一戰?
在全球以企業主導的ADC藥物臨床研發共約350項,中國約166項,占比約為47%,全球在研ADC藥物的靶點前三分別為HER2、TROP2和CLDN18.2。
HER2是目前全球ADC藥物開發的頭號靶點,全球有接近50款已上市或在研的靶向HER2的ADC藥物,其中有3款已經獲批上市,分別是羅氏的Kadcyla、第一三共的Enhertu還有首款國產ADC藥物榮昌生物的RC48(維迪西妥單抗)。
在國內市場,HER2同樣是ADC研發的頭號靶點,Claudin-18.2、Trop-2等靶點的競爭亦非常激烈,從研發進度上來看目前國內的企業研發的ADC藥物多數處于早期研究,進展較快的集中于HER2和TROP2等靶點。
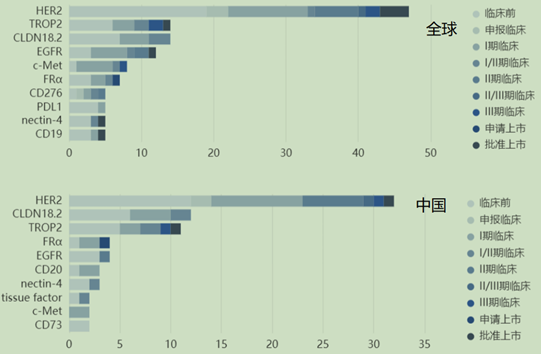
圖5 全球和中國ADC藥物臨床階段各靶點占比
來源:東吳證券
在國內,榮昌生物自主研發的HER2ADC維迪西妥單抗已經獲批上市用于治療胃癌和尿路上皮癌,還在就治療多種實體瘤進行臨床試驗,如乳腺癌、非小細胞肺癌、膽道癌、婦科惡性腫瘤、晚期黑色素瘤等。除此之外,恒瑞的SHR-A1811、東曜藥業的TAA013等也已經進入3期臨床……
小結
ADC藥物現在是生物醫藥醫藥領域最為火熱的賽道之一,Enhertu的大賣必將該賽道的競爭推向白熱化,DS-8201的降維打擊不僅讓T-DM1膽戰心驚,后面一眾跟進的企業想要在DS-8201的絞殺下分一杯羹更是談何容易。
去年百奧泰最終宣布停止ADC項目BAT8001,Ambrx Biopharma宣布考慮到HER2靶點的競爭格局,將HER2 ADC ARX788移出內部研發管線,雖然將與合作伙伴新碼生物繼續合作推動ARX788的開發,但是能夠在頭對頭試驗中勝出結果未可知。
這些故事給所有后來者都敲響了警鐘。
目前來看,無論是全球還是中國在整個ADC領域都存在適應癥和靶點扎推的現象,HER2靶點更是成為焦點,DS-8201的優異表現讓所有HER2 ADC賽道的玩家都如坐針氈,在ADC領域誰有能力與之一戰,我們拭目以待!
參考資料:
1.ADC爆發,半年營收翻倍,阿斯利康......
2.剛剛!重磅ADC藥物DS-8201,獲NMPA受理,AZ為它花了69億美元!
3.69億美元!阿斯利康與第一三共達成腫瘤學戰略合作,開發靶向HER2的抗體藥物偶聯物DS-8201。
4.第一三共將在2022年ESMO年會上介紹DXd ADC產品組合,全力推動腫瘤領域進展
5.第一三共二季度報、華創證券、東吳證券、國金證券、FDA等網上公開資料。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容