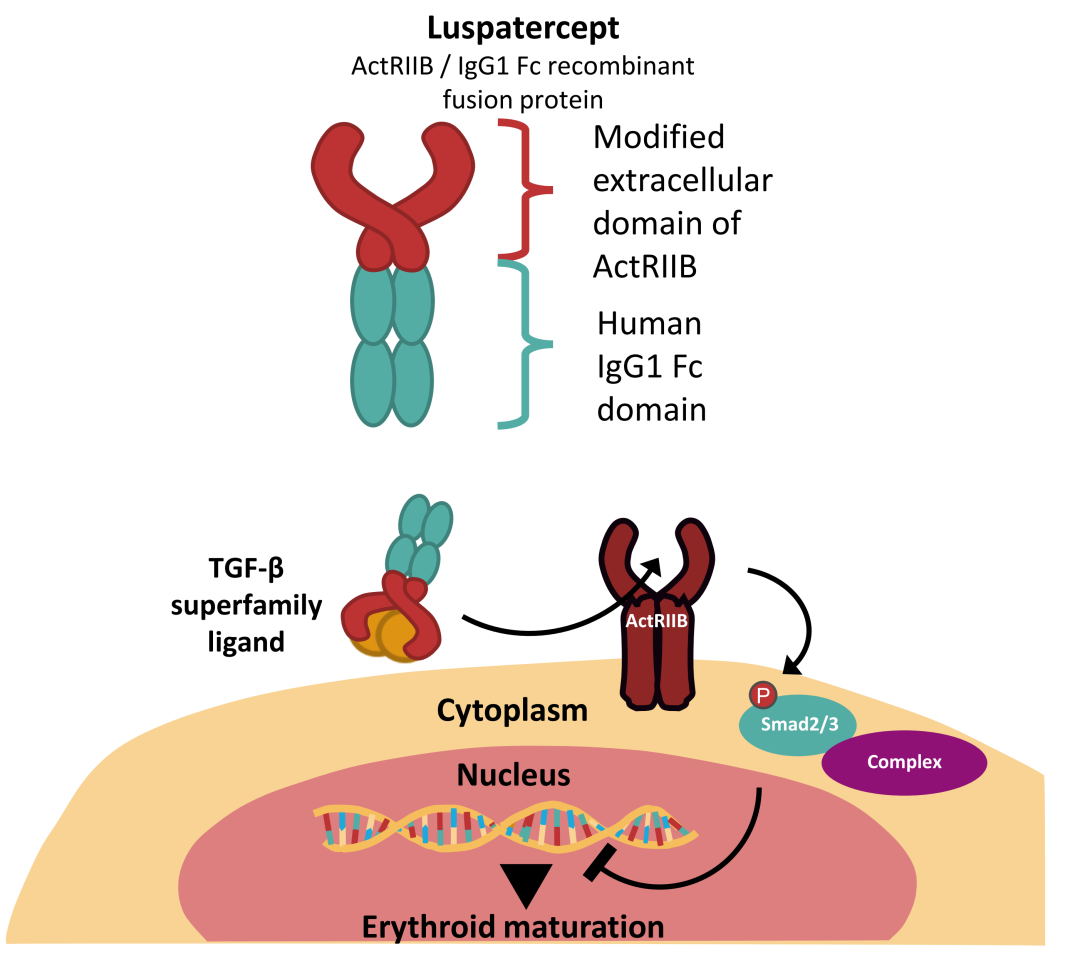
10月31日,BMS發布公告:羅特西普(luspatercept-aamt,Reblozyl)一線治療輸血依賴性骨髓增生異常綜合征(MDS)的III期COMMAND研究達到中期分析的主要終點。MDS是一組起源于造血干細胞的異質性髓系克隆性疾病,其特點是髓系細胞發育異常,臨床表現為無效造血和難治性血細胞減少。MDS患者可能會出現感染、貧血、自發性出血和容易出現瘀斑等癥狀。發生貧血的MDS患者通常需要定期輸血,以增加血液循環中的健康紅細胞數量。然而,頻繁輸血會增加鐵超負荷、輸血反應和感染的風險。在美國,每年約有1萬例MDS確診患者,其中約30%會發展為急性髓系白血病(AML)。MDS可在任何年齡發病,但最常見于60歲及以上人群。羅特西普是由默克和BMS合作開發的一種激活素受體2B(ACVR2B)-Fc融合蛋白,可通過與特定TGF-β超家族配體(調控紅細胞成熟的關鍵因子)結合,降低異常增強的Smad 2/3信號通路的轉導,從而恢復晚期紅細胞成熟,使機體能夠產生更多正常紅細胞。羅特西普最初由Acceleron Pharma開發,2011年8月,新基(已被BMS收購)與Acceleron達成合作,共同負責該產品的開發、生產和商業化。2021年11月,默克以115億美元收購Acceleron,順勢獲得羅特西普。2019年11月,羅特西普首次在美國獲批上市,用于治療輸血依賴性β-地中海貧血患者。2020年4月,羅特西普獲批新適應癥,用于治療極低至中風險且存在環形鐵幼粒細胞的MDS(MDS-RS)或存在環形鐵幼粒細胞且伴有血小板增多癥的MDS/骨髓增生性腫瘤患者的貧血,這些患者接受過紅細胞生成刺激劑(ESA)治療但無效,需要定期輸注紅細胞且紅細胞輸注≥2單位/8周。今年1月,羅特西普在國內獲批用于治療需要定期輸注紅細胞且紅細胞輸注≤15單位/24周的β-地中海貧血成人患者。COMMANDS研究是一項開放標簽、隨機、陽性藥物對照的III期臨床試驗,共納入347例患者,旨在評估羅特西普對比epoetinα治療極低至中風險(由IPSS-R系統評估)MDS引起的貧血患者的有效性和安全性,這些患者需要定期進行紅細胞(RBC)輸血且未接受過ESA治療。試驗的主要終點是第12周患者的紅細胞輸血獨立性(RBC-TI),并且其平均血紅蛋白水平提高≥1.5g/dL。關鍵的次要終點包括第24周的RBC-TI,12周及以上的RBC-TI和在第1-24周期間至少8周的紅細胞反應。中期分析結果顯示,羅特西普組患者實現了具有高度統計學意義和臨床意義的RBC-TI,同時血紅蛋白水平有所提高。此外,羅特西普的安全性與先前在MEDALIST研究中的結果一致,并且沒有報告新的安全信號。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容