
2022-10-12 16:32:18來源:藥智頭條瀏覽量:943
導讀:盤點表觀遺傳抗癌藥物研發進展
近日,第一三共的EZHARMIA(Valemetostat,伐美妥司他)(DS-3201, DS-3201b)在日本獲批上市,用于治療難治性白血病、淋巴癌,成為第一款獲得監管批準的EZH1/2 雙重抑制劑。
伐美妥司他是一款first-in-class的EZH1/2雙重抑制劑,在 T 細胞和 B 細胞淋巴瘤中都顯示出活性,這使得它在治療淋巴瘤的藥物中脫穎而出,因為絕大多數藥物只能治療其中一種。臨床實驗顯示伐美妥司他使 48% 的患者腫瘤縮小,包括 20% 治療后沒有癌癥跡象的患者。
在中國,針對相同靶點的國產新藥HH2835也正在中美同時進行臨床試驗。該藥是海和生物與中國科學院上海藥物所共同研究開發的一種新型、高效、特異 性的 EZH1/2 雙重抑制劑,目前是國內唯一在中國申報臨床研究的 EZH 抑制劑。
圖1. 第一三共公司的Ezharmia(伐美妥司他 )獲批用于治療復發或難治性成人 T 細胞白血病/淋巴瘤
圖源:fierce新聞
EZH1和EZH2都屬于組蛋白甲基轉移酶,是主要的表觀遺傳調控因子。表觀遺傳學藥物,乍一聽還比較陌生,但實際上相關研究已有50多年歷史。
什么是表觀遺傳學?
表觀遺傳學(Epigenetics)是與遺傳學(genetic)相對應的概念,表觀遺傳學被定義為“在基因組序列不變的情況下 ,可以決定基因表達與否并可穩定遺傳下去的調控密碼”。染色質凝聚、松弛結構的形成,以及開放、閉合等狀態的轉換提供了一種超越 DNA 序列本身的調控機制,即表觀遺傳調控。
腫瘤細胞通常利用表觀遺傳調控機制激活癌基因表達程序。與遺傳變化不同,表觀遺傳變化是可逆的,不會改變我們的 DNA 序列,但它們可以改變我們身體讀取 DNA 序列的方式。染色質是最早確定的癌癥治療靶點,早在20世紀70年代,科學家們就已經開始設計可以和DNA甲基化相關的改變染色質的促分化藥物。
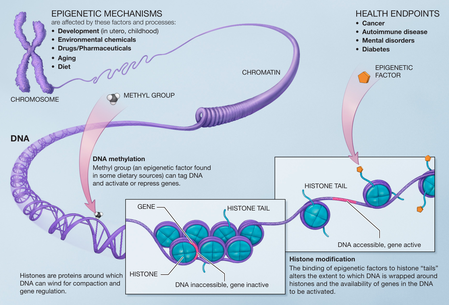
圖2.表觀遺傳機制 圖源:Wikipedia
而來自不同來源的化合物,包括中草藥,食品和飲料,通過影響疾病發病過程中的表觀基因組和基因表達的機制發揮有益的健康作用。通過針對所謂的表觀遺傳“讀者”、“作者”和“擦除者”,化學物質可以逆轉癌細胞和癌前階段的異常表觀基因組特征。因此,此類藥物通過預防或治療/治療策略為癌癥攔截提供了途徑。之前大部分研究關注都集中在寫入器(例如,組蛋白乙酰轉移酶)和擦除器(例如,組蛋白脫乙酰酶)上,而較少關注表觀遺傳讀取器(例如,組蛋白甲基轉移酶)。
直到2012年哈佛大學科學家齊軍合成的著名基因“開關分子” JQ1 被開發為表觀遺傳“讀者”抑制劑,選擇性地靶向BET家族成員 BRD4。將 JQ1 作為單藥或與標準護理療法聯合進行的臨床試驗顯示出抗腫瘤功效,但因為毒性或耐藥性的問題需要進一步開發新一代靶向表觀基因學相關靶點的藥物。
表觀遺傳學藥物開發策略
齊軍博士最近在《藥物化學雜志》特刊“表觀遺傳學 2022”發表綜述,討論了過去五年中針對表觀遺傳讀取器,靶向組蛋白甲基轉移酶(HMTs)的各種藥物設計策略:包括非共價抑制劑、共價抑制劑、PROTACs降解劑等。
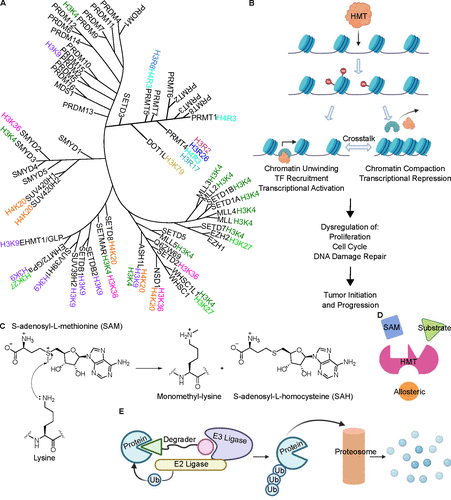
圖3. 癌癥中的組蛋白甲基轉移酶及其靶向方法。(A) 人類組蛋白甲基轉移酶的系統發育樹,分為組蛋白賴氨酸甲基轉移酶 (HKM) 和組蛋白精氨酸甲基轉移酶 (HRM)。(B) 組蛋白甲基化失調可導致腫瘤發生和癌癥進展。(C) 使用 SAM 輔因子的賴氨酸單甲基化機制。(D) 甲基轉移酶抑制方法。(E) 通過 PROTAC 進行靶向蛋白質降解。
圖源:齊軍教授論文
組蛋白甲基轉移酶(HMTs)的異常表達會導致癌癥相關基因組蛋白甲基化異常,從而促進腫瘤發生。組蛋白甲基轉移酶與化療耐藥和免疫刺激有關,使這些酶成為潛在的治療靶點,小分子靶向這些蛋白質為癌癥治療中的新藥開發提供了途徑。
組蛋白甲基轉移酶 (HMTs) 分為兩類:賴氨酸甲基轉移酶 (KMTs) 和精氨酸甲基轉移酶 (PRMTs)。KMTs的失調與許多疾病的原因有關,包括癌癥、精神健康障礙和發育障礙。KMTs可分為含 SET 結構域和非 SET 結構域。SET 結構域是組蛋白甲基轉移酶的重要結構域,負責甲基轉移酶的酶促活性,包括 SUV39, SET1, SET2, EZH (EZH1和EZH2已有藥物上市),RIZ (PRDM, SMYD, SUV420) 等家族。而不含 SET 結構域的蛋白較少,如 DOT1L 蛋白。DOT1L 是已知的靶向組蛋白 H3K79 位置的組蛋白甲基轉移酶。在過去的十年中,在開發靶向參與組蛋白甲基化和表觀遺傳調控的 KMT 的藥物方面取得了重大進展。這些抑制劑中的第一個里程碑泰澤思他(tazemetostat),2020年被批準用于治療上皮樣肉瘤和濾泡性淋巴瘤,目前該藥國內的三期臨床也在進行中。
而PRMTs 目前在哺乳動物中鑒定出九種,根據其催化活性可分為三類,催化精氨酸的單甲基化 (MMA),不對稱 (ADMA) 或對稱二甲基化 (SDMA)。I 型 PRMTs (PRMT1, PRMT2, PRMT3, PRMT4, PRMT6 和 PRMT8) 產生單或不對稱二甲基化精氨酸 (ADMA),II 型 PRMTs (PRMT5 和 PRMT9) 產生單或對稱二甲基化精氨酸 (SDMA)。而 Ⅲ 型的 PRMT7,只產生 MMA。由于 PRMT 家族成員在各種癌癥類型中的作用越來越重要,因此新藥研發管線有很多針對 PRMT 家族成員的選擇性抑制劑。PRMT4、PRMT5 和 PRMT7 已成為越來越有希望的治療靶點,因為有報道稱這些蛋白質的過表達和失調促進了一系列實體癌和血癌的腫瘤發生。這些酶不僅可以作為單一療法的靶點,也可以用于克服耐藥性和促進免疫反應的組合策略。
針對 EZH2、DOT1L 和多個 PRMT 家族成員的多種抑制劑已經開發成功或正在進行臨床實驗。比如Epizyme旗下的DOT1L抑制劑pinometostat(EPZ-5676)進入了臨床試驗,但其臨床活性不高。G9A抑制劑EZM8266、PRMT5抑制劑等。
國內上海科技大學也報道過非核苷類DOT1L抑制劑DC_L11。為了克服抑制劑的不足最近文獻報道了不少靶向HMT的 PROTAC降解劑:例如通過將 CRBN結合子沙利度胺與模仿 SAM結構的 EZH2 抑制劑 GSK126 和 EPZ6438(Tazemetostat)相結合,開發了一系列 EZH2 特異性 PROTAC。與 EZH2 抑制劑相比,基于 GSK126 的降解劑對 EED 和 SUZ12 的降解能力更強,此外,EZH2 的完全降解被證明可以消除其致癌功能,包括減少甲基化,這是目前 EZH2 抑制劑沒有實現的壯舉。
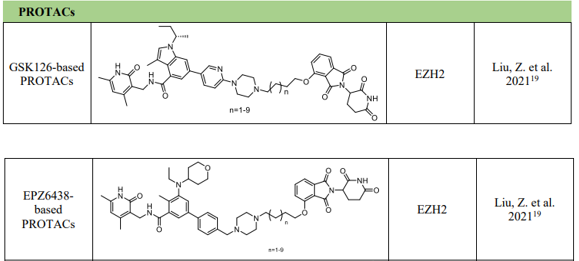
圖4 靶向EZH2的降解劑結構。圖源:參考文獻
靶向組蛋白甲基化修飾的蛋白抑制劑一覽
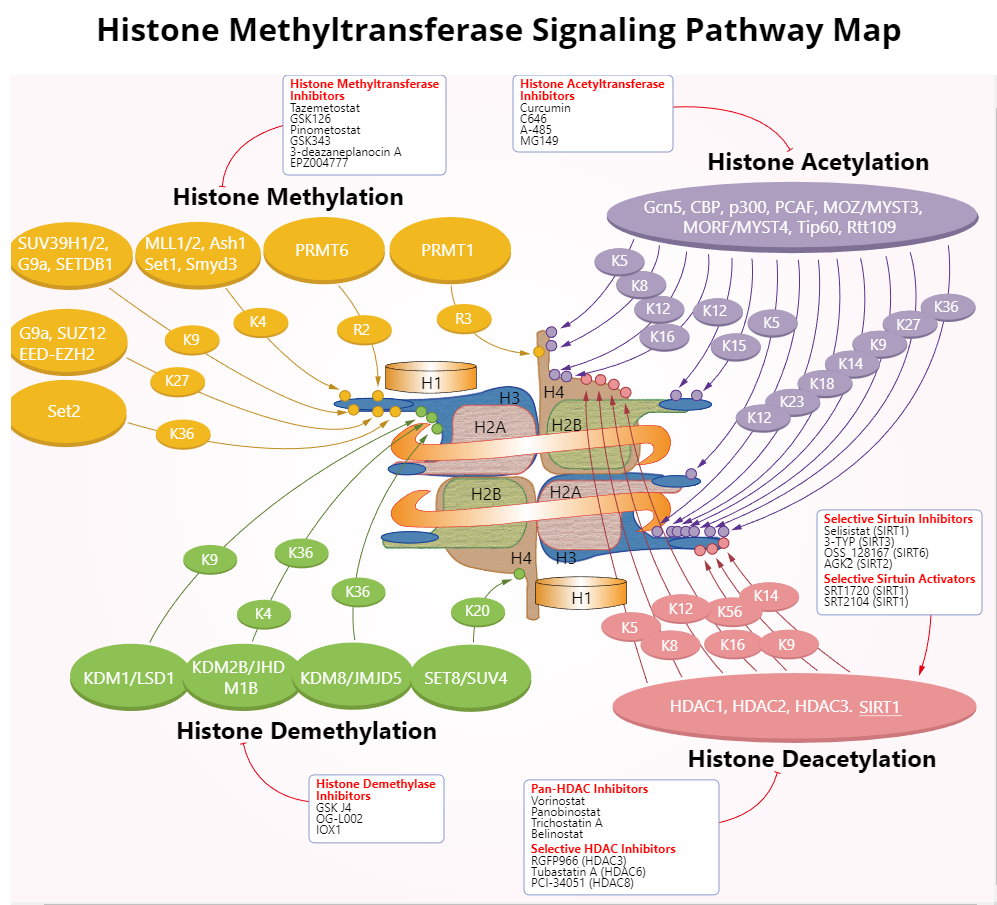
圖 5 組蛋白甲基轉移酶信號通路圖
圖源:Selleck
小 結
靶向 HMT 的小分子抑制劑和降解劑已顯示出用于癌癥治療的巨大潛力,這從進入臨床試驗開發階段的抑制劑數量、化學生物學方法的持續進步以及對 HMT 在疾病中作用的科學興趣的增加可以看出狀態和作為藥物反應的介質將導致這些化合物的進一步開發和改進。
與此同時,高通量化合物篩選平臺的進步和可用性的增加大大擴展了已經存在的潛在 HMT 選擇性抑制劑的范圍。此外,計算化學方法,包括使用晶體結構和分子對接也使得新藥研發有了更多工具。
盡管 HMT 靶向化合物開發取得了令人興奮的進展,但與激酶抑制劑和傳統化療相比,表觀遺傳修飾探針作為一個整體在化合物有效性所需的時間方面仍存在不足。另一方面表觀遺傳治療進展還是主要集中在血液腫瘤,實體瘤還需要更多的工作。
表觀遺傳學誕生已經接近50年,相關研究越來越深入;盡管已經填補了一些知識空白,而更多的疑問也不斷涌現。另一個挑戰是大多數表觀基因改變為功能丟失性突變,很難治療。表觀遺傳藥物和經典化療、靶向藥物、其他表觀遺傳藥物以及免疫檢查點抑制劑聯合使用也許比單藥使用效果更好。
總之,表觀遺傳相關的蛋白是一類重要的治療靶點。考慮到潛在靶點數目之多,需要系統發現和驗證潛在藥物靶點來進行藥物研發,才能達到理想療效。
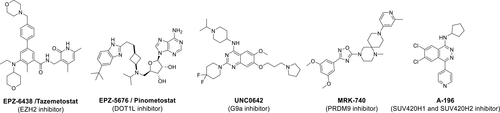
圖6一些選擇性抑制劑的結構
圖源:參考文獻
參考文獻:
1. 表觀遺傳學
https://www.encyclopedie-environnement.org/zh/sante-zh/epigenetics-how-the-environment-influences-our-genes/
2. 齊軍教授綜述
https://pubs.acs.org/doi/pdf/10.1021/acschembio.2c00062
3. 表觀遺傳2022特刊
https://pubs.acs.org/page/vi/epigenetics
4. JQ1的故事
https://open.163.com/newview/movie/free?mid=MA47G39CR&pid=MA44S7L2U
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容