“水蛇海德拉(Lernaean Hydra)是希臘神話中的怪物。傳說它有九顆頭,砍下其中一顆后,它的脖子上會立刻長出兩顆新頭。為了殺死九頭蛇,宙斯之子赫拉克勒斯(Heracles)砍斷這怪物的所有頭部,用火灼燒并壓上沉重的石頭,讓它再也不能作怪。”用九頭蛇來形容癌癥十分貼切。腫瘤原發灶和轉移灶常具有不同的分子圖譜,而且腫瘤內部也可能存在巨大的異質性。因此,腫瘤治療需要從“照本宣科”的單一治療(predetermined monotherapies)轉向個性化的聯合治療(customized matched combinations)。多條不同的信號通路和基因突變驅動著腫瘤的生長,腫瘤的“九個頭”必須被全部砍掉才能徹底殺死它,而個性化(N-of-1)(注:即為單個患者制定基于證據的治療決策)聯合治療可能就是殺死癌癥這條九頭蛇的關鍵。圖片來自:Ann Oncol. 2022; S0923-7534(22)01861-0.
2022年8月2日,《腫瘤學年鑒》(Annals of Oncology)發表了一篇重磅綜述,通過重新思考傳統治療策略下的腫瘤緩解、繼發性耐藥后的治療以及個性化聯合治療,為我們展示了一個不一樣的視角。
“混合”緩解(“mixed” responses)一般來說,癌癥治療后緩解可分為完全緩解(CR)、部分緩解(PR)、疾病穩定(SD)或疾病進展(PD)。然而,也觀察到其他重要的緩解模式,例如,在有兩個以上轉移性病灶的患者中,可能一個部位縮小,而另一個部位增大;或者,一個或多個部位縮小,但出現新病灶,這類情況被稱為“混合”緩解(“mixed” responses)。目前臨床醫生會將此類患者歸為疾病進展,并為其轉換不同的系統治療,或轉為姑息治療。然而,混合緩解可使我們重新認識腫瘤緩解、耐藥機制以及腫瘤異質性。惡性腫瘤由各種克隆組成,每種克隆可能以不同的方式對治療藥物產生應答。藥物可能誘導敏感克隆消退,也可能促進不同耐藥克隆生長,這表現為對現有治療的耐藥和傳統意義上的疾病進展。有時,敏感克隆對治療產生耐藥性,可能是因為在治療壓力下出現新的基因組改變。這時,敏感克隆雖然處于靜止狀態但仍然是存在的。如果敏感克隆仍潛伏在腫瘤中,改變治療方案可能導致其重新活躍。如果敏感和耐藥克隆存在于不同位點,它們將產生混合緩解,含有敏感克隆的腫瘤縮小,含有耐藥克隆的腫瘤生長增大(圖1A)。另一情況是,如果在同一腫瘤灶內同時存在敏感和耐藥克隆,則可能會觀察到腫瘤或縮小或增大,或繼發耐藥(縮小后增大),具體情況則取決于每個克隆對治療的應答動力學(圖1B)。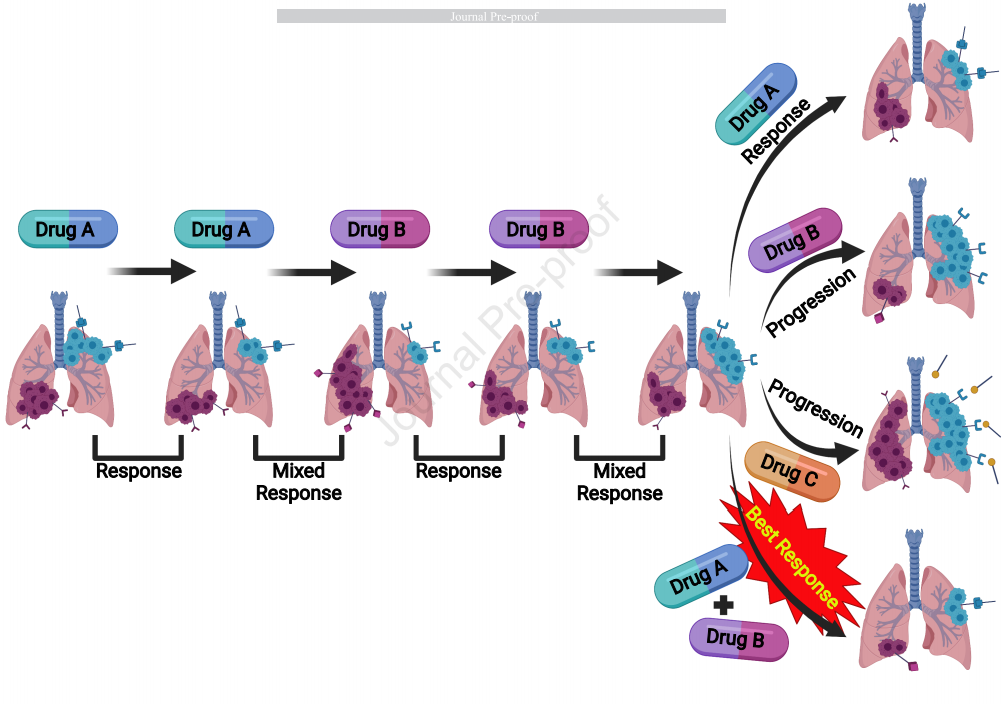
轉移性癌癥在不同的腫瘤部位含有不同的克隆,可能反映了不同的驅動基因突變因素。當單一驅動基因突變匹配單一分子靶向治療,如“克隆A”與“藥物A”,腫瘤雖然消退,但“藥物A”對由不同突變驅動的“克隆B”的影響極小或無影響。隨著時間的推移,當“克隆B”變大顯示“進展”時,即使“克隆A”顯示對治療的反應,也會發生混合緩解。當轉換為“藥物B”以靶向進展的“克隆B”并停用“藥物A”時,也會發生相同的情況;“克隆B”可能顯示對治療的反應,但“克隆A”在進展。
這時,下一步的疾病管理可能是:1) 用“藥物A”再治療,可能在“克隆A”中產生反應;2) 繼續用“藥物B”,可能導致“克隆A”繼續進展;3) 轉換為新的“藥物C”,如果它不靶向任一克隆,將導致進展;或 4) 結合“藥物A”和“藥物B”靶向在不同克隆/轉移位點發現的兩種先前反應的基因突變,而這有可能產生最佳緩解。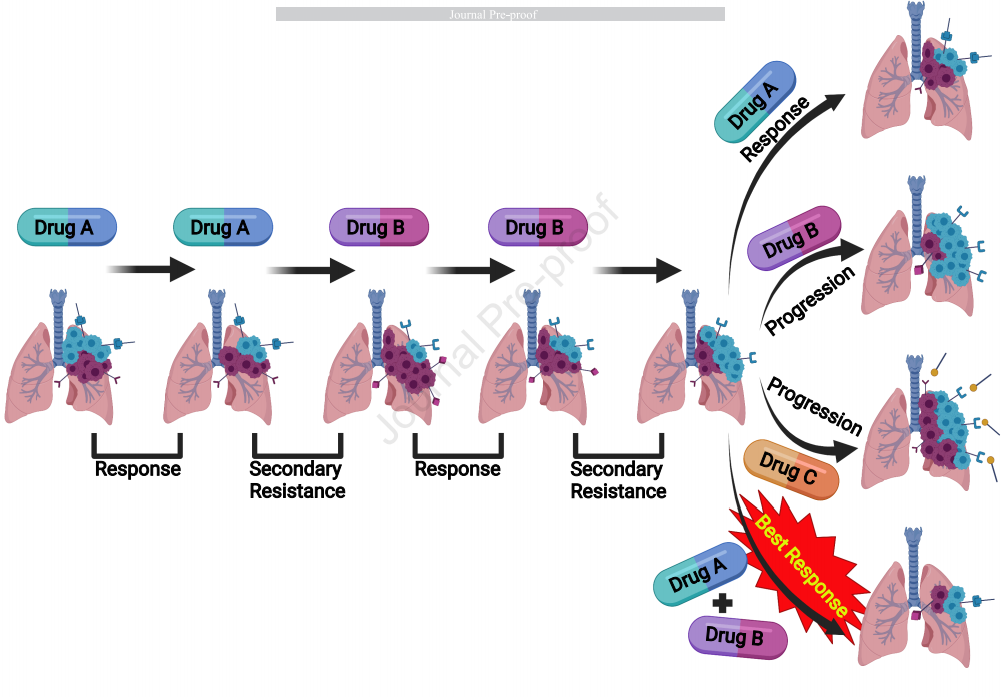
同一部位異質性腫瘤克隆可能反映了與混合緩解揭示的相同的過程。由于克隆共存于同一腫瘤中,因此觀察不到混合緩解。腫塊消退或生長取決于每個克隆的動力學及其對特定治療的反應性。混合緩解可能經常發生,如在一項非小細胞肺癌(NSCLC)患者研究中,21.5%的患者觀察到混合緩解。免疫治療中的混合緩解則是一個更為復雜的場景,在免疫檢查點抑制(ICI)治療中,腫瘤對治療的應答可在緩解、混合緩解、進展、假性進展(pseudoprogression)、超進展(hyperprogression)和寡轉移性進展(oligometastatic progression)中反復無常。在一項觀察轉移性黑色素瘤患者對免疫治療混合緩解的回顧性研究中,入組了292例患者接受伊匹木單抗(ipilimumab)和/或納武利尤單抗(nivolumab)治療,并將治療反應分為3組:緩解(轉移病灶消退且不存在復發或新病灶)、混合緩解(轉移灶中同時有消退部位和進展部位)和進展(轉移灶進展且無任何腫瘤消退部位)。結果發現,在這些患者中103例(35%)患者被歸類為緩解,64例(22%)患者表現出混合緩解 ,125例(43%)患者在治療中進展。對于混合緩解患者,共有38例患者隨后對治療有緩解,22例患者最終在治療期間進展,6例患者有穩定的混合緩解。混合緩解在免疫治療的背景下可能具有潛在生物特性,致使其有時會發生不同于靶向或化療的混合緩解。特別是,一些混合緩解可能是由于局部免疫炎癥反應導致腫瘤生長的假象,就像發生假性進展一樣。有趣的是,現在已經有文獻證明,靶向治療也可能發生假性進展,因此,對于多種治療類型,尤其是免疫治療,混合緩解可能反映不同腫瘤部位的不同克隆,或可能提示與微環境的炎癥過程有關。眾所周知,如果腫瘤獲得完全緩解后停藥,之后疾病復發的時間較晚,則可通過重新給予原始治療方案獲得第二次完全緩解,這在淋巴瘤和白血病中尤為重要,盡管第二次完全緩解的持續時間較短;另一種情況是,腫瘤最初有緩解,但患者在隨后的治療中再次生長,這種情況則被稱為繼發性耐藥。這種類型的繼發性耐藥可能在動力學上類似于完全緩解后復發,唯一的區別是繼發性耐藥的初始緩解不完全。傳統的腫瘤學教條告訴我們,發生繼發性耐藥了,再治療是無效的。但是,在一些小樣本的研究中觀察到對繼發性耐藥后再治療可以再次緩解,這些文章的發表對這種無用論提出了質疑。繼發耐藥后再治療的一些應答機制與完全緩解后復發再治療機制相似,這一理論是合理的。在有些情況下,繼發性耐藥可能類似于混合緩解(如上圖1B),只是不同的克隆共存于同一腫塊中。在第一次成功治療后出現的新克隆可能被新的治療所抑制,但新的治療可能同時允許重新出現原始克隆,因此用原始藥物重新治療可能有效。有研究支持關于停藥后再治療的這些概念。如已有BRAF抑制劑成功再治療BRAF-V600突變黑色素瘤的報告。此外,在一篇EGFR單抗在轉移性結直腸癌(mCRC)中的再治療的綜述中,EGFR單抗再治療為二線以上的mCRC患者提供了臨床獲益(ORR=2.9-53.8%;DCR= 40.0-89.7%)。在用相同的藥物再治療的基礎上加用另外一個藥物補充治療方案,這種有效性機制可能是需要另外一個藥物來解決新出現的克隆,同時保持原始的藥物來抑制原始克隆。在一項HER2陽性晚期乳腺癌進展后繼續使用曲妥珠單抗的研究中顯示,在曲妥珠單抗治療期間發生進展的HER2陽性乳腺癌女性患者中,與卡培他濱單藥治療相比,繼續曲妥珠單抗聯合卡培他濱治療顯示總緩解和至進展時間顯著改善。此外,在一項大型結直腸癌觀察性隊列研究中,與貝伐珠單抗治療后進展方案中未包含貝伐珠單抗的患者相比,繼續接受貝伐珠單抗聯合新藥的患者生存期顯著延長。多項證據證實了克隆異質性在臨床中的影響。結果是各種各樣的腫瘤應答情況和再治療模式,越來越多地表明存在多種通路和克隆驅動腫瘤生長。因此,腫瘤的治療經常是在“打地鼠”(“whack-A-mole”),也類似于殺死希臘神話里的九頭蛇,當你砍下其中一顆頭的時候,它立馬長出兩個顆新頭,除了對腫瘤進行初始活檢以確定靶向的各種基因突變外,治療癌癥這條九頭蛇的一個重要概念就是早期確定繼發性耐藥機制,并在出現耐藥克隆時“全部砍斷”。幸運的是,基于ctDNA的新一代液體活檢技術的出現,液體和組織活檢的動態監測可能及時捕獲驅動腫瘤進展的新克隆。因此,照本宣科單藥治療可能是無效的,無法為患者提供持久的緩解。一些藥物作為單藥治療時常常表現不佳,但當在適當背景下聯合使用時恰能產生持久的緩解,這就可能是因為患者的惡性腫瘤中存在一種以上的驅動基因改變。還有一個重要的問題是藥物A與藥物B的聯合治療是否就優于序貫治療?例如在評估EGFR抑制劑單藥治療胃癌和CDK抑制劑單藥治療乳腺癌的療效等研究中,雖然諸如CDK抑制劑與抗雌激素藥物的聯合用藥表明從一開始就需要聯合用藥,但聯合治療與序貫治療的問題仍需要更為廣泛性的回答。聯合治療當然還有其他重要的考慮因素。如 Palmer et al. 所示,聯合方法可能導致更高的緩解率,不是由于協同或疊加效應,而是當應用于無生物標志物選擇的人群時,能靶向該人群中的不同亞組。后者強調了每位患者分子圖譜的至關重要性,以便將給予他們的藥物組合限制在那些會引起其腫瘤應答的藥物上,從而減少可能僅影響人群中其他亞組的藥物的毒性。傳統上,癌癥臨床試驗沒有考慮到患者癌癥之間的差異,以試錯的方式為一組患者中的每個人提供相同的藥物。這幾年,這些問題已經在基于生物標志物的靶向藥物試驗中得到解決。然而,這些試驗大多針是對單一靶向藥物及其同源分子異常。對于免疫治療,臨床試驗通常仍適用于無生物標志物和無免疫組學分析的人群。考慮到腫瘤異質性的概念,旨在克服這一現象是關鍵。異質性可能發生在患者之間或患者內部。解釋患者間異質性可能通過更深入地分析腫瘤和患者特異性特征來實現。為了解釋患者內的異質性,需要不同的方法,如液體活檢、疾病進展的再活檢或放射組學等。因此,患者內的異質性意味著個性化聯合治療可能對優化腫瘤應答至關重要。
圖片來自:Ann Oncol. 2022; S0923-7534(22)01861-0.
基于上述數據,可能有必要將混合緩解的患者或繼發性耐藥患者特別提出來,放到當前的試驗模式層級之外的“框架”中。這些混合緩解或繼發性耐藥腫瘤就是九頭蛇的外在表現,當解決一個問題時,新的問題又重新出來。在假設毒性可耐受的情況下,新出現的數據表明了在疾病進展或混合緩解后當前治療方案再治療的可能性。此外,液體和組織活檢的應用可用于了解耐藥機制,并有望闡明可添加到現有治療方案中的新的可靶向突變。最重要的是,由于治療或時間壓力,腫瘤是一個由克隆進化驅動的“移動靶點”,在疾病早期的創新聯合療法可能有助于對抗癌癥的異質性,并殺死癌癥這條九頭蛇。備注:文章封面圖片來自《A Total War Saga: TROY》 中的游戲人物,由藝術家Kalin Popov創作。
Adashek JJ, Subbiah V, Westphalen CB, Naing A, Kato S, Kurzrock R. Cancer: Slaying the 9-headed Hydra [ published online ahead of print, 2022 Aug 2]. Ann Oncol. 2022; S0923-7534(22)01861-0. doi: 10.1016/j.annonc.2022.07.010聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!