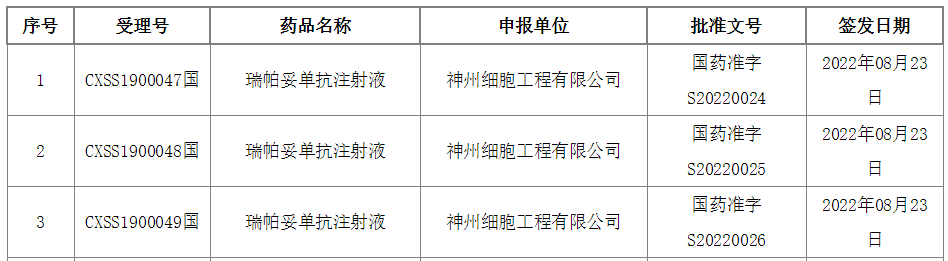
今日(8月30日),中國國家藥監(jiān)局(NMPA)官網(wǎng)最新公示,神州細胞遞交的瑞帕妥單抗(ripertamab,SCT400)的上市申請已獲得批準。公開資料顯示,瑞帕妥單抗是一款新型的抗CD20單抗,本次獲批的適應癥為聯(lián)合CHOP(環(huán)磷酰胺+多柔比星+長春新堿+潑尼松)方案治療彌漫性大B細胞淋巴瘤。
彌漫性大B細胞淋巴瘤(DLBCL)是最常見的非霍奇金淋巴瘤類型,它是一種進展迅速的侵襲性疾病。對于這類患者,抗CD20單抗是基石的治療藥物。瑞帕妥單抗是神州細胞自主研發(fā)的一種人鼠嵌合IgG1型抗CD20單克隆抗體,它的結(jié)構(gòu)中包含了30%的鼠抗CD20單克隆抗體的可變區(qū)Fab,以及70%的人IgG1抗體穩(wěn)定區(qū)Fc片段?根據(jù)神州細胞早前發(fā)布的新聞稿,與利妥昔單抗相比,瑞帕妥單抗的恒定區(qū)序列選用中國人血細胞提取的最常見天然IgG1同種異型G1m(1,17),在CH1區(qū)第219位的氨基酸存在差異——即瑞帕妥單抗是纈氨酸,而利妥昔單抗則為丙氨酸。這樣的一個氨基酸改變可以在保證藥物有效性的前提下盡可能地降低藥物的免疫原性?2019年12月,中國國家藥監(jiān)局藥品審評中心(CDE)受理了瑞帕妥單抗的上市申請。根據(jù)神州細胞早前發(fā)布的新聞稿,該藥本次申請上市的適應癥為聯(lián)合CHOP方案治療DLBCL患者。在一項3期臨床試驗中,研究人員比較了瑞帕妥單抗-CHOP與利妥昔單抗-CHOP治療初治DLBCL患者的療效和安全性?該研究共納入了364例初治DLBCL患者,研究的主要終點為客觀緩解率(ORR)?根據(jù)2022年7月發(fā)表在Hematological Oncology雜志上的試驗數(shù)據(jù):- 兩組的ORR及完全緩解率(CRR)無顯著差異。在獨立影像學委員會(IRC)評估的ORR方面,瑞帕妥單抗-CHOP組為94.5%,利妥昔單抗-CHOP組為94.1%;在CRR方面,瑞帕妥單抗-CHOP組為70.5%,利妥昔單抗-CHOP組為75.4%。
- 兩組間的1年無進展生存期(PFS)和3年總生存期(OS)無顯著差異。在1年PFS率方面,瑞帕妥單抗-CHOP組和利妥昔單抗-CHOP組分別為81.1%、83.2%;在3年OS率方面,瑞帕妥單抗-CHOP組為81.0%,利妥昔單抗-CHOP組為82.8%。
- 瑞帕妥單抗-CHOP和利妥昔單抗-CHOP兩組總體安全性相似,無新的不良事件發(fā)生;在部分不良事件(如肺部炎癥、間質(zhì)性肺疾病、免疫原性等)方面,瑞帕妥單抗聯(lián)合CHOP組更具優(yōu)勢。
綜合以上數(shù)據(jù),研究認為:與利妥昔單抗-CHOP方案相比,瑞帕妥單抗聯(lián)合CHOP治療DLBCL療效具有非劣效性;而且,瑞帕妥單抗的免疫原性更低,在某些安全性事件上有一定優(yōu)勢?神州細胞相信瑞帕妥單抗的獲批將會為中國臨床及患者提供一種新的治療選擇?參考資料
[1]2022年08月30日藥品批準證明文件待領取信息發(fā)布 . Retrieved Aug 30,2022, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220830162157187.html
[2] 國產(chǎn)新型抗CD20單抗——瑞帕妥單抗III期臨床研究結(jié)果正式發(fā)表. Retrieved Aug 15,2022, from https://mp.weixin.qq.com/s/YVLlfDp2SZrgLKjPYFppFw
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容!



