8月24日,科濟藥業(股票代碼:2171.HK)公布2022中期業績。
業績亮點速覽
- CT053完成中國關鍵II期臨床試驗入組,計劃于2022年第三季度在國內提交NDA
- CT041被FDA授予“再生醫學先進療法”(RMAT)
- CT041中國研究者發起試驗的數據在《Nature Medicine》發表
- 持續開發創新CAR-T技術,布局下一代管線候選產品
- 美國CGMP生產工廠啟動運營,于下半年支持北美臨床試驗
- 委任科濟藥業首席醫學官及旗下美國公司總裁,加強領導團隊力量
科濟藥業董事長、首席執行官、首席科學官李宗海博士表示:回顧2022年上半年,雖然疫情帶來了一些挑戰,但科濟藥業在管線產品的臨床開發、技術創新及在中國和美國的業務運營方面,均取得了重大的進展。目前,CT041已成為全球首個且唯一進入確證性II期臨床試驗的實體瘤CAR-T產品,CT053即將于第三季度在國內提交NDA申請。公司位于美國的CGMP生產工廠也啟動運營。我們持續推進CAR-T技術創新以攻克行業重大挑戰,同時我們也建立了獨立自主、垂直一體化的生產能力。我們將始終秉承“科創濟世”的愿景,早日為全球癌癥患者帶來創新和差異化的細胞療法,也為廣大投資者和社會公眾創造更多價值。
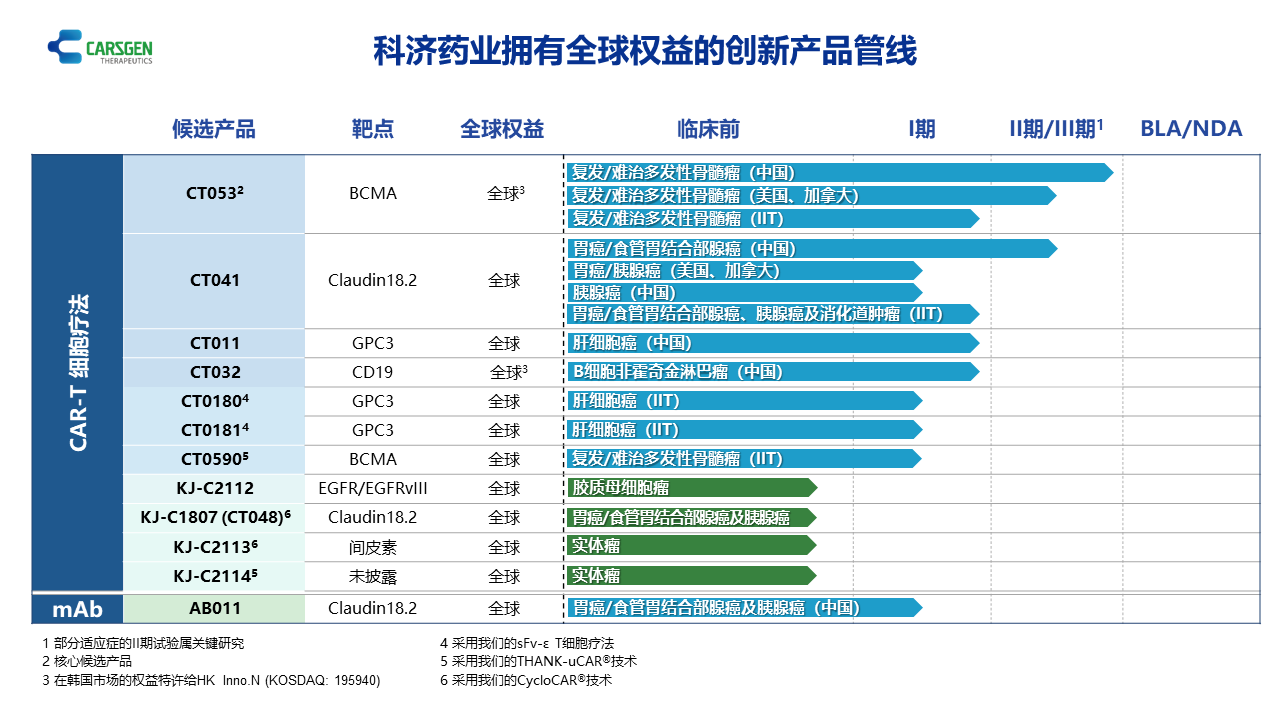
產品管線穩步推進,實體瘤CAR-T保持領先
CT053是一種升級的、用于治療復發/難治多發性骨髓瘤(R/R MM)的全人抗BCMA自體CAR-T細胞候選產品。其融合了具有較低免疫原性和較高穩定性的全人抗BCMA特異性單鏈抗體的CAR結構,在沒有腫瘤相關靶點的情況下,可降低CAR-T細胞的自動激活,克服了T細胞耗竭的問題。CT053就治療R/R MM于2019年獲得美國FDA的再生醫學先進療法(RMAT)及孤兒藥認定,以及就治療R/R MM于2019年獲得歐洲藥品管理局(EMA)的優先藥物(PRIME)資格及于2020年獲得孤兒藥產品認定,并就治療R/R MM于2020年獲得國家藥監局的突破性療法認定。科濟已經完成中國關鍵性II期試驗(LUMMICAR STUDY 1)的患者入組,并計劃于2022年第三季度向國家藥監局提交新藥上市申請(NDA)。科濟正在北美進行關鍵性2期試驗(LUMMICAR STUDY 2),并計劃于2023年向美國FDA提交生物藥物上市許可申請(BLA)。公司亦計劃進行額外臨床試驗,以開發CT053作為多發性骨髓瘤的早期治療方法。CT053中國研究者發起的試驗(IIT)研究結果于2022年在《Haematologica》雜志發表。CT041是一種全球潛在同類首創的,靶向Claudin18.2(CLDN18.2)蛋白的自體CAR-T細胞候選產品。CT041用于治療CLDN18.2陽性實體瘤,主要治療胃癌/食管胃結合部癌(GC/GEJ)及胰腺癌(PC)。科濟在全球范圍內率先成功識別、驗證并報告CLDN18.2可作為實體瘤的相關抗原,是治療CLDN18.2普遍及高表達的實體瘤CAR-T細胞療法的可行靶點。CT041就治療GC/GEJ于2020年取得美國FDA的孤兒藥認定以及就治療晚期胃癌于2021年取得EMA的孤兒藥產品認定。CT041就治療晚期胃癌于2021年獲EMA授予PRIME資格,及就治療CLDN18.2陽性晚期GC/GEJ于2022年獲得RMAT認定。截至公告日,CT041是全球首個且唯一進入到確證性II期臨床試驗的用于治療實體瘤的CAR-T細胞候選產品。科濟正在進行的試驗包括在北美的一項針對晚期GC/GEJ和PC的1b/2期臨床試驗(CT041-ST-02,NCT04404595),在中國的一項針對晚期GC/GEJ和PC的Ib期臨床試驗和一項針對晚期GC/GEJ的確證性II期臨床試驗(CT041-ST-01,NCT04581473)以及IIT。科濟計劃于2024年上半年向中國國家藥監局提交NDA。CT041在美國現已完成劑量爬坡并已啟動劑量擴展。科濟亦計劃于2022年下半年在北美啟動一項2期臨床試驗,并于2024年向美國FDA提交BLA。CT041在美國的1b期研究(NCT04404595)的結果及在中國的Ib/II期研究(NCT04581473)的結果于2022年6月舉行的2022年美國臨床腫瘤學會(ASCO)年會上以壁報形式進行展示。中國研究者發起的試驗的結果于2022年5月在《Nature Medicine》發表,是首個發表于頂級學術期刊的迄今為止最大樣本量的CAR-T細胞治療實體瘤臨床研究。AB011是一種靶向CLDN18.2的人源化單克隆抗體候選產品,用于治療CLDN18.2陽性實體瘤。科濟就靶向CLDN18.2的單克隆抗體取得該靶點全球第二項試驗用新藥(IND)許可。科濟正在中國進行AB011用于治療CLDN18.2陽性實體瘤的I期臨床試驗,現已完成I期單藥入組并啟動聯合化療階段試驗。科濟已建立了涵蓋整個CAR-T開發周期的綜合研發平臺,包括靶點發現、抗體開發、載體設計、制造、質量保證以及質量控制。科濟持續投身于推進CAR-T技術創新,以攻克行業重大挑戰。公司的四大戰略支柱包括:(1)療效:為提升治療實體瘤的療效,科濟持續開發下一代CAR-T技術,如CycloCAR?。CycloCAR?的特色是在CAR-T細胞中共同表達細胞因子IL-7和趨化因子CCL21,有望產生更高的臨床療效并減少清淋化療預處理。(2)安全性:為提高過繼性細胞療法的適用性,科濟開發了基于sFv-ε的T細胞療法,其由GPC3靶向的scFv和CD3ε亞單位組成的全T細胞受體(TCR)復合物提供動力,可與其他TCR亞單位形成功能性TCR復合物,重定向T細胞以非MHC依賴性方式殺傷腫瘤細胞。(3)患者可及性:科濟正在開發使用THANK-uCAR?技術的同種異體CAR-T細胞候選產品。公司認為該技術有望促進CAR-T細胞的增殖、持久性及療效。公司相信,成功應用THANK-uCAR?技術將大幅降低CAR-T細胞療法的成本,提高患者可及性。(4)靶點可用性:科濟開發了LADAR?技術(由人工受體驅動的局部作用),其中人工受體由LADAR?配體觸發,誘導目標基因的轉錄。通過LADAR?人工受體,只有當LADAR?與LADAR?配體結合時,才會觸發抗腫瘤CAR轉錄,從而可以精準控制免疫細胞何時及于何種情況下作用于癌細胞。目前上述技術均為自主研發,擁有全球權益,可單獨或結合使用以升級科濟的現有候選產品及產生未來的管線候選產品。截至2022年6月30日,科濟擁有超過300項專利,其中有70項為全球(包括中國、美國、歐洲及日本)授權專利。相較2021年底,增加了7項授權專利及21項專利申請。科濟已建立了自主、垂直一體化的生產能力,包括質粒生產、慢病毒載體生產和CAR-T細胞生產。公司持續擴大在中國和美國的全球產能,以支持臨床試驗和隨后的管線產品的商業化。利用公司在上海徐匯區的臨床生產工廠以及位于上海金山區的商業GMP生產工廠,公司能夠獨立自主地生產CAR-T細胞以支持在中國的臨床試驗,以及獨立自主地生產慢病毒載體以支持全球的臨床試驗。今年,公司通過啟動位于美國北卡羅來納州達勒姆三角研究園(RTP)的CGMP生產工廠,于擴大公司在中國以外的產能方面取得重大進展。工廠順利通過了官方檢查,并已獲得達勒姆市縣檢驗局頒發的合規證書,并經與FDA進行RMAT協商后啟動RTP生產工廠的調試、資質及驗證工作。同時,科濟一直在執行向RTP生產工廠的技術轉讓,推進CT041及CT053產品的臨床生產。截至2022年6月30日,科濟共有601名雇員。公司亦加強了領導團隊的力量:聘請Raffaele Baffa博士擔任科濟藥業首席醫學官及Richard Daly先生擔任CARsgen Therapeutics Corporation(科濟藥業旗下美國公司)總裁。高級管理人員履歷詳情載于公司網站(www.CARsgen.com)。科濟藥業(股票代碼:2171.HK)是一家在中國及美國擁有業務的生物制藥公司,主要專注于治療血液惡性腫瘤和實體瘤的創新CAR-T細胞療法。我們建立了一個綜合細胞治療平臺,其內部能力涵蓋從靶點發現、抗體開發、臨床試驗到商業規模生產。我們通過自主研發新技術以及擁有全球權益的產品管線,以解決CAR-T細胞療法的重大挑戰,比如提高安全性,提高治療實體瘤的療效和降低治療成本。我們的使命是成為能為全球癌癥患者帶來創新和差異化的細胞療法,并使癌癥可治愈的全球生物制藥領導者。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!