
2022-07-26 16:16:18來源:藥方舟瀏覽量:291
7月25日,Veru公司宣布,英國藥品和保健品管理局(MHRA)支持加快審查其自主研發(fā)的 sabizabulin用于中重度新冠住院患者治療急性呼吸窘迫綜合征(ARDS)的上市許可申請。

Sabizabulin(bisindole, VERU-111)是Veru開發(fā)的一款口服雙吲哚類化合物,其通過結(jié)合微管蛋白的"秋水仙堿結(jié)合位點"來抑制微管蛋白,從而阻斷新冠病毒沿微管的細胞內(nèi)運輸。同時,Sabizabulin具有抗炎作用,可以防止新冠病毒感染引起的細胞因子風(fēng)暴。
7月6日,NEJM Evidence刊登了sabizabulin的III期臨床試驗結(jié)果。這是一項隨機、多中心、安慰劑對照的III期臨床試驗,旨在評估sabizabulin治療具有急性呼吸窘迫綜合征(ARDS)和死亡風(fēng)險的中重度新冠肺炎患者的有效性和安全性。研究共納入約210名受試者,按2:1的比例隨機接受sabizabulin(9mg、每日口服一次)或安慰劑治療。主要終點是在60天內(nèi)的全因死亡率,關(guān)鍵次要終點是在重癥監(jiān)護病房(ICU)的天數(shù)、接受機械通氣的天數(shù)和住院的天數(shù)。
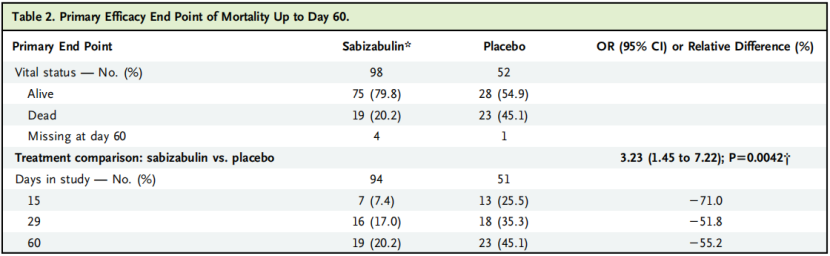
研究結(jié)果表明,sabizabulin治療組的死亡率為20.2%(19/94),而安慰劑組的死亡率為45.1%(23/51)。與安慰劑相比,sabizabulin將患者的死亡風(fēng)險相對降低了55.2%(P=0.0042),同時不良事件和嚴重不良事件的發(fā)生率更低。對于關(guān)鍵次要終點,與安慰劑相比,sabizabulin將ICU天數(shù)(P=0.0013)相對減少了43%,機械通氣天數(shù)(P=0.0013)相對減少了49%,住院天數(shù)(P=0.0277)相對減少了26%。與此同時,與安慰劑組相比,sabizabulin組的不良事件和嚴重不良事件發(fā)生率較低。
6月7日,Veru宣布,已向FDA提交sabizabulin(bisindole)的緊急使用授權(quán)申請(EUA),用于治療中重度新冠住院患者。
Sabizabulin是首個在臨床和統(tǒng)計學(xué)上顯著降低中度至重度新冠住院患者死亡風(fēng)險的藥物。除新冠外,Sabizabulin還被開發(fā)用于治療去勢抵抗前列腺癌、三陰性乳腺癌、HR陽性乳腺癌等。
參考文獻
DOI: 10.1056/EVIDoa2200145
聲明:本文系藥方舟轉(zhuǎn)載內(nèi)容,版權(quán)歸原作者所有,轉(zhuǎn)載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內(nèi)容、版權(quán)和其它問題,請與本網(wǎng)站留言聯(lián)系,我們將在第一時間刪除內(nèi)容!