今日,中國國家藥品監督管理局(NMPA)官網最新公示,樂普生物抗PD-1抗體普特利單抗注射液的上市申請已獲得批準。公開資料顯示,此次該產品獲批的適應癥為:適用于既往接受一線及以上系統治療失敗的微衛星高度不穩定(MSI-H)/錯配修復功能缺陷(dMMR)實體瘤患者的治療。

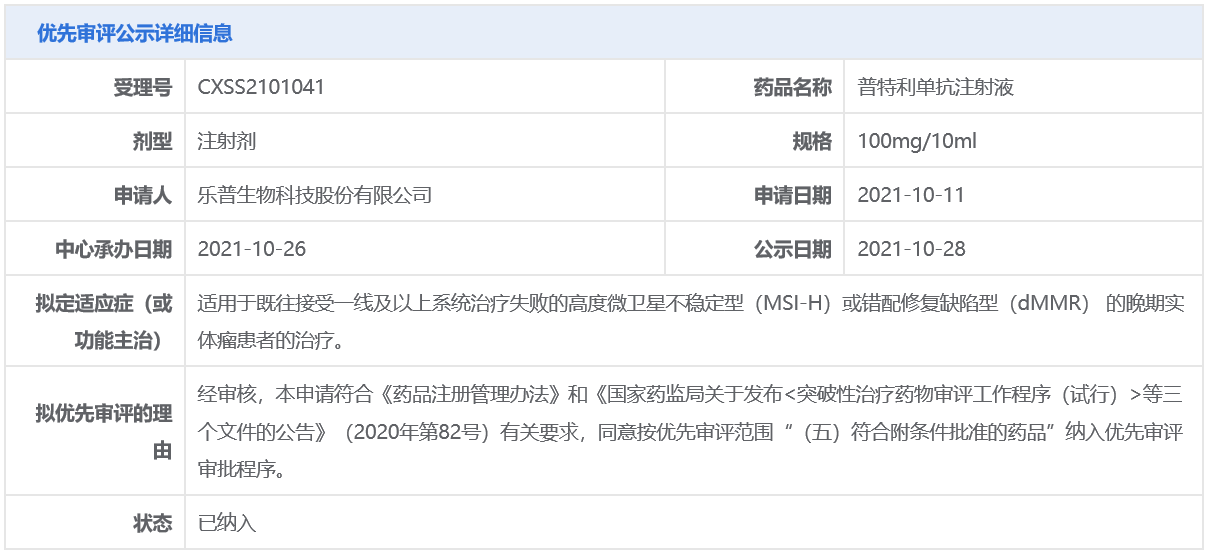
據樂普生物早前公開資料介紹,普特利單抗(pucotenlimab)是通過使用人IgG4亞型針對人PD-1的人源化單抗。它可以拮抗PD-1信號,通過阻斷PD-1與其配體PD-L1及PD-L2的結合來恢復免疫細胞殺死癌細胞的能力。同時,普特利單抗采用抗體工程技術,于Fc區引入突變,提高FcRn的結合親和力,從而大幅延長其半衰期,提高患者的臨床療效及藥物依從性。根據公開資料,樂普生物分別于2021年6月和2021年10月向NMPA提交了普特利單抗的2項適應癥上市申請,分別用于治療黑色素瘤和MSI-H/dMMR實體瘤。其中,MSI-H/dMMR實體瘤的上市申請還曾被中國國家藥監局藥品審評中心(CDE)納入優先審評,具體適應癥為:適用于既往接受一線及以上系統治療失敗的MSI-H或dMMR的晚期實體瘤患者的治療。
此次,普特利單抗獲批的適應癥即為MSI-H/dMMR實體瘤。MSI-H與dMMR是常見的遺傳異常,含有這類變異的腫瘤會影響細胞內的DNA修復機制,可出現在乳腺、前列腺、結直腸、胃等多個部位。在2021年美國臨床腫瘤學會(ASCO)會議上,樂普生物匯報了普特利單抗用于MSI-H/dMMR實體瘤的多中心2期臨床研究結果。數據顯示,在共納入100名均為二線及以上的患者中,86例達到初步反應評價。研究主要終點客觀緩解率(ORR)達到47.67%,疾病控制率(DCR)為75.58%,6個月和12個月無進展生存期(PFS)率分別為62.66% 和52.70%。結果表明,普特利單抗在二線及以上MSI-H/dMMR晚期實體瘤患者中顯示出有希望的療效和可控的安全性。除了MSI-H/dMMR實體瘤,樂普生物還在其它適應癥上探索普特利單抗的治療效果,例如黑色素瘤、胃癌或胃食管結合部癌二線治療、非小細胞肺癌(NSCLC)、三陰性乳腺癌(TNBC)、非肌層浸潤性膀胱癌(NMIBC)、肝細胞癌(HCC)等。此外,該公司還正在開展普特利單抗與溶瘤病毒產品、抗PD-L1抗體等聯合療法的臨床試驗。希望樂普生物普特利單抗此次獲批上市,能夠為更多癌癥患者提供新的治療選擇。
參考資料:
[1]2022年07月22日藥品批準證明文件待領取信息發布 .Retrieved July 22,2022, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220722090109108.html[2]樂普生物招股書. Retrieved Apr 28, 2021, from https://www1.hkexnews.hk/app/sehk/2021/103373/documents/sehk21042802764_c.pdf[3] Efficacy of HX008 in high microsatellite instability/mismatch repair–defificient (MSI-H/dMMR) solid tumors: Results from a multicenter phase II open-label study. From https://ascopubs.org/doi/abs/10.1200/JCO.2021.39.15_suppl.2572[4]樂普生物發布2021年全年業績報告|資本市場助力,臨床管線多點開花 . Retrieved Mar 29,2022, from https://mp.weixin.qq.com/s/V_3DiYK0FrqsVEC40dh0vg
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!



