
2022-07-08 14:29:31來源:醫藥魔方info瀏覽量:370
近日,國家藥品監督管理局藥品審評中心(CDE)官網顯示,默沙東MK-4830注射液臨床申請已獲受理。
免疫球蛋白樣轉錄子4 (ILT4) 受體——也稱為白細胞免疫球蛋白樣受體B2 (LILRB2) - 是ILT家族的免疫抑制成員,通常在許多骨髓譜系表達,包括單核細胞、巨噬細胞、粒細胞和樹突狀細胞。在腫瘤微環境中,ILT4通常表達于單核骨髓源性抑制細胞(MDSC)和粒細胞性MDSC中。ILT4的典型配體是人類白細胞抗原G (HLA-G),這是一種在腫瘤細胞廣泛表達的非經典MHC I類分子,其表達與預后不良有關。其他幾種ILT4配體,包括經典的人類白細胞抗原(HLA)和血管生成素樣蛋白,也可能與驅動ILT4介導的腫瘤微環境免疫抑制有關。
MK-4830是一款first-in-class全人源IG4亞型抗ILT4單抗,可特異性結合 ILT4并阻斷其與HLA-G和其他配體的相互作用。MK-4830最初于Agenus公司發現,后來默沙東獲得了該款產品的開發授權。
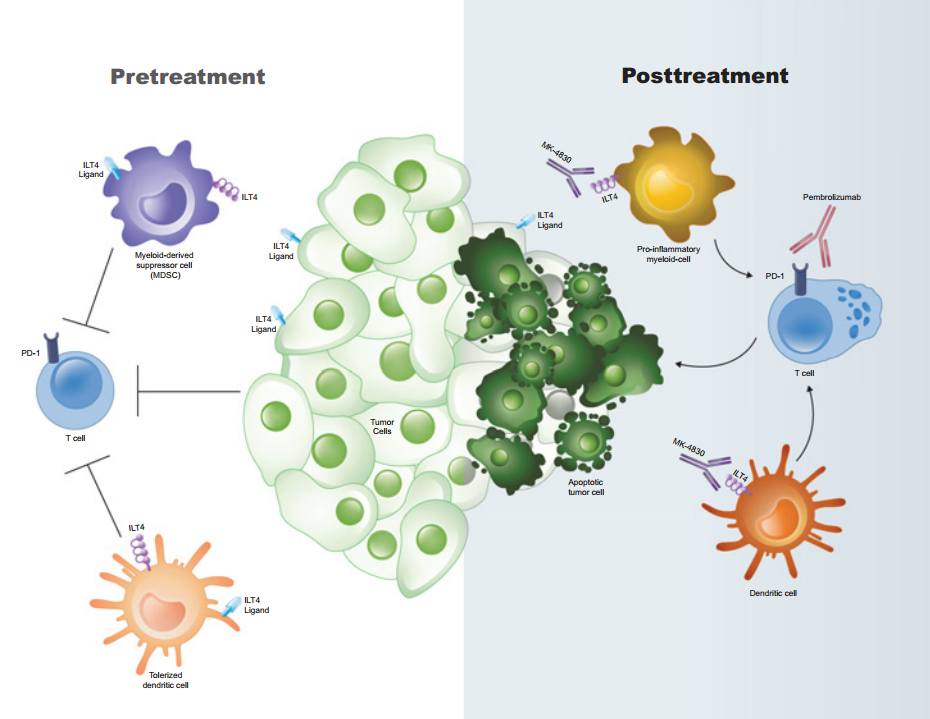
MK-4830聯合Keytruda治療實體瘤的首個人體I期研究數據顯示,患者ORR為24%,在11例先前接受過PD-1治療的患者中有5例患者產生應答(45%)。

在國內,早在今年3月以明生物醫藥已經申報了ILT4抑制劑IO-108的臨床申請,是國內首家。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!