
2022-03-07 16:29:18來源:米內網瀏覽量:550
摘要abstract
2月CDE共承辦藥品注冊申請711件
10個存量品種首次有企業申報一致性評價
億一生物、上海海和藥物、北京四環制藥3個1類新藥首次報產
仿制申請中有16個品種暫無國產獲批
7個2類新藥獲批,其中3個新劑型,4個新增適應癥
4個首仿品種獲批,9個存量品種迎首家過評
CDE總體承辦情況
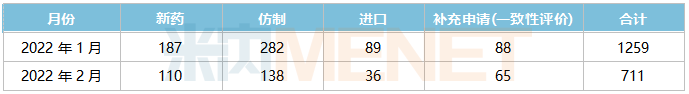
據米內網MED2.0中國藥品審評數據庫統計,2022年2月CDE共承辦藥品注冊申請711件。
2022年1月-2月CDE承辦藥品注冊申請情況(按受理號計)
一致性評價補充申請承辦情況
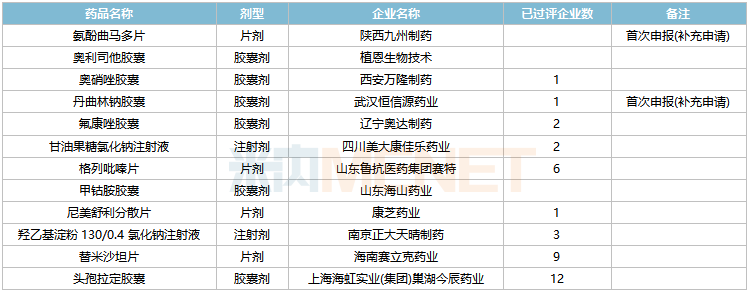
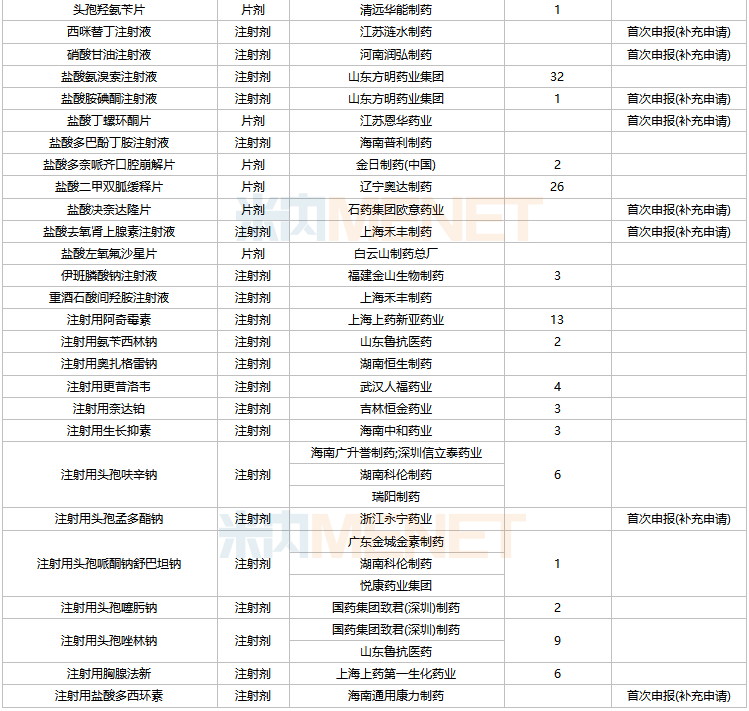
2022年2月,39個品種的一致性評價補充申請獲CDE承辦。其中氨酚曲馬多片、丹曲林鈉膠囊、西咪替丁注射液、硝酸甘油注射液、鹽酸胺碘酮注射液、鹽酸丁螺環酮片、鹽酸決奈達隆片、鹽酸去氧腎上腺素注射液、注射用頭孢孟多酯鈉、注射用鹽酸多西環素等10個品種為首次申報。
2月CDE補充申請(一致性評價)品種承辦情況
新藥申請承辦情況
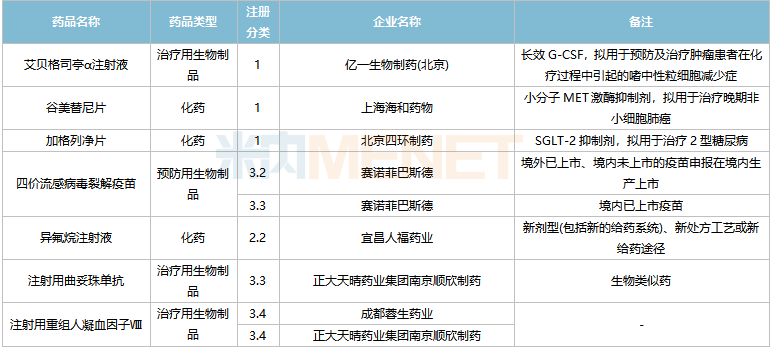
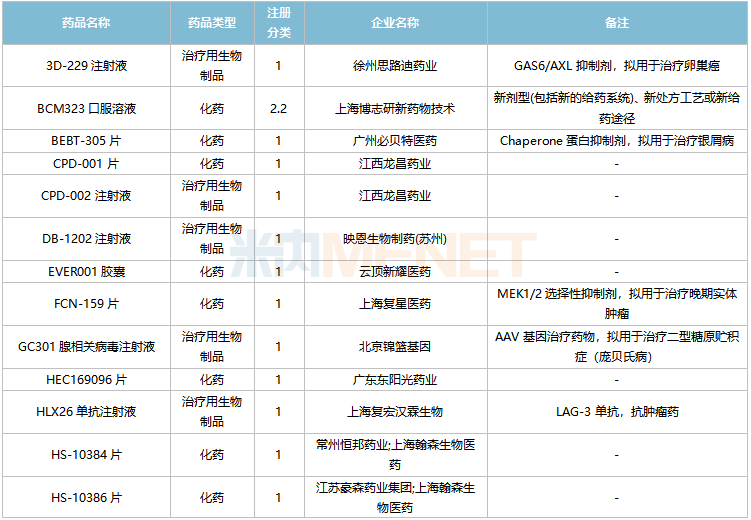
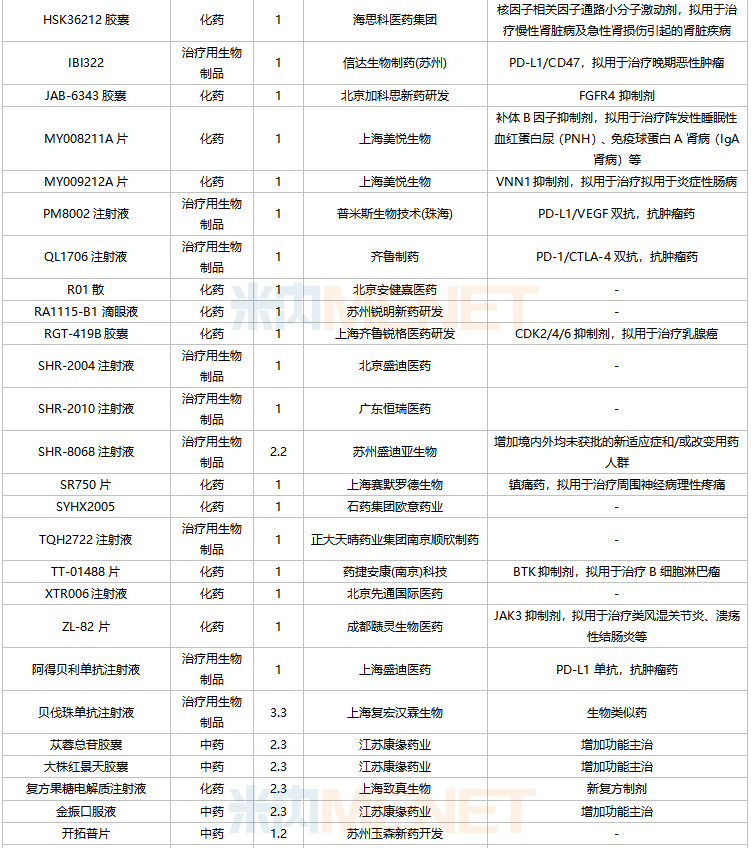
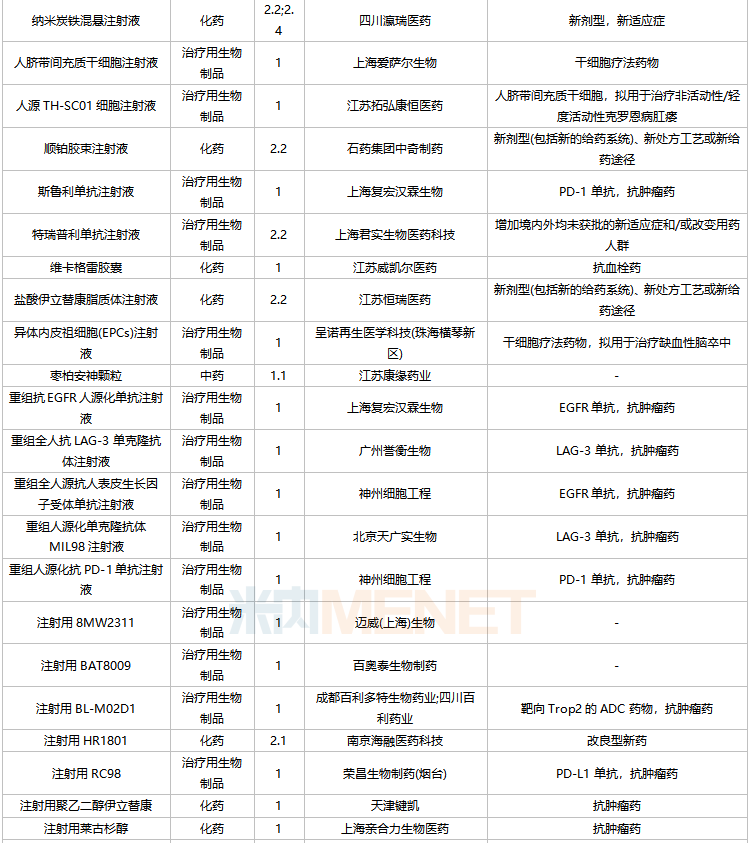
2022年2月,73個品種的新藥申請獲CDE承辦。其中1類新藥有55個,2類改良型新藥有14個,3.3類生物類似藥2個。
億一生物制藥(北京)的艾貝格司亭α注射液、上海海和藥物的谷美替尼片、北京四環制藥的加格列凈片等3個1類新藥為首次申報上市。
2月國內新藥上市申請承辦情況
2月國內新藥臨床申請承辦情況



仿制申請承辦情況
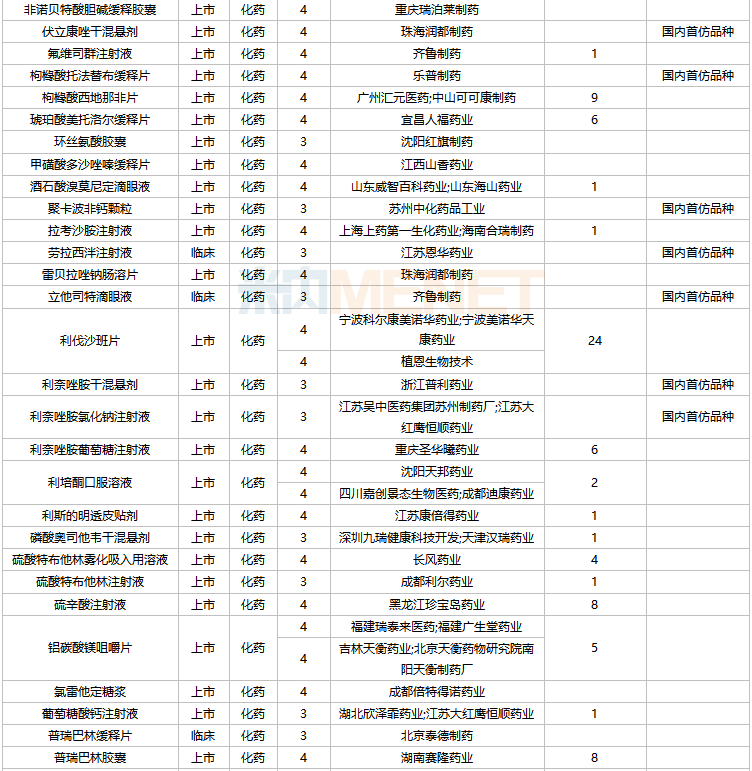
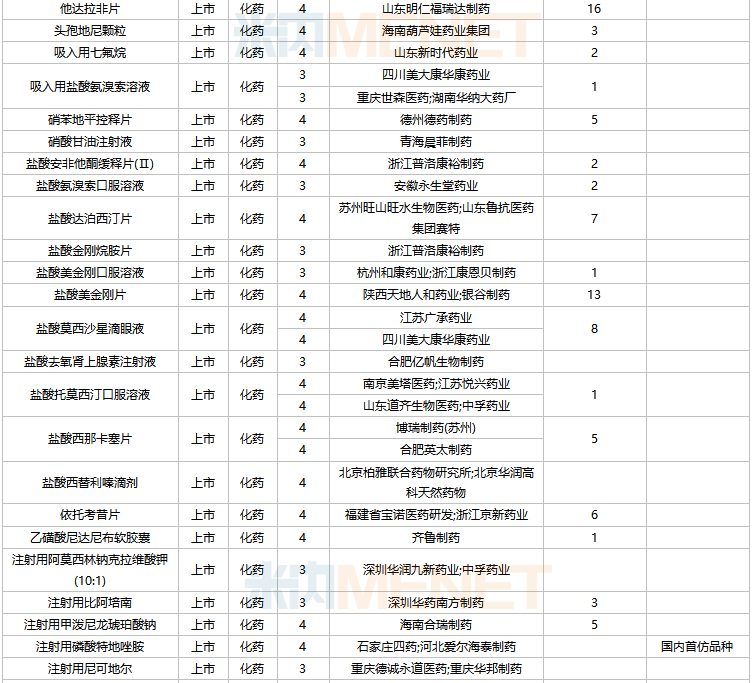
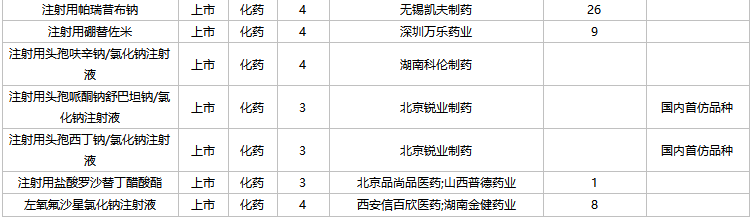
2022年2月,83個品種的仿制申請獲CDE承辦,其中:艾地骨化醇軟膠囊、奧貝膽酸片、奧美沙坦酯氨氯地平氫氯噻嗪片、丙酸氟替卡松霧化吸入用混懸液、伏立康唑干混懸劑、枸櫞酸托法替布緩釋片、聚卡波非鈣顆粒、勞拉西泮注射液、立他司特滴眼液、利奈唑胺干混懸劑、利奈唑胺氯化鈉注射液、瑞戈非尼片、舒更葡糖鈉注射液、注射用磷酸特地唑胺、注射用頭孢哌酮鈉舒巴坦鈉/氯化鈉注射液、注射用頭孢西丁鈉/氯化鈉注射液等16個品種暫無國產獲批。
2月國內仿制申請承辦情況


進口申請承辦情況
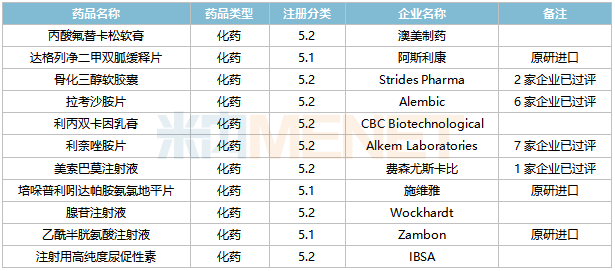
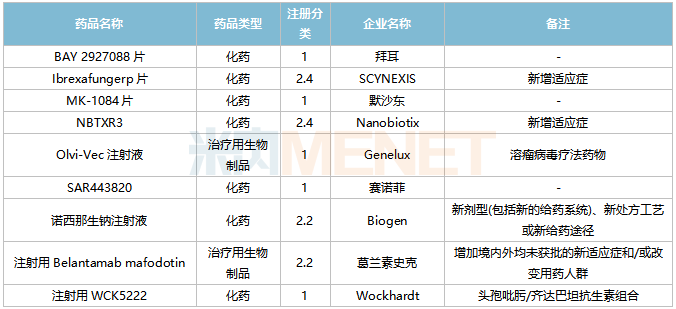
2022年2月,20個品種的進口申請獲CDE承辦。其中1類新藥有5個,2類改良型新藥有4個,5.1類進口原研藥有3個,5.2類進口仿制藥有8個。
2月進口上市申請承辦情況
2月進口臨床申請承辦情況
獲批情況
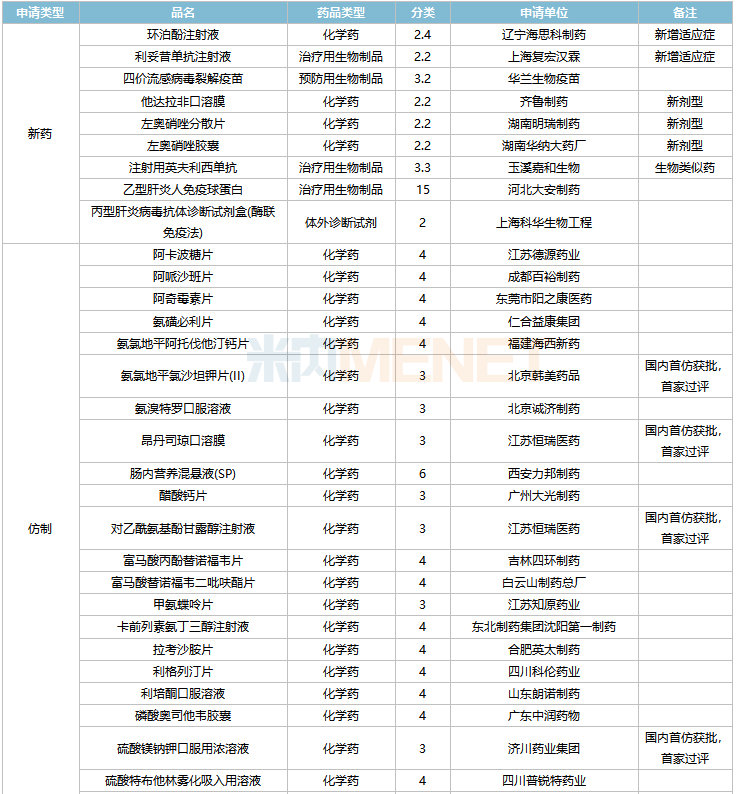
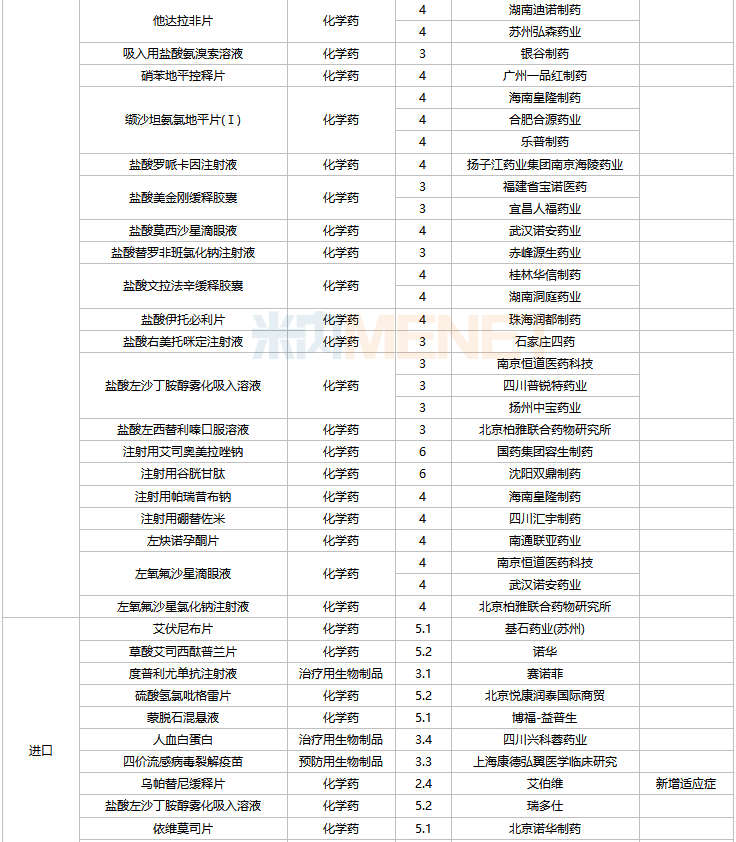
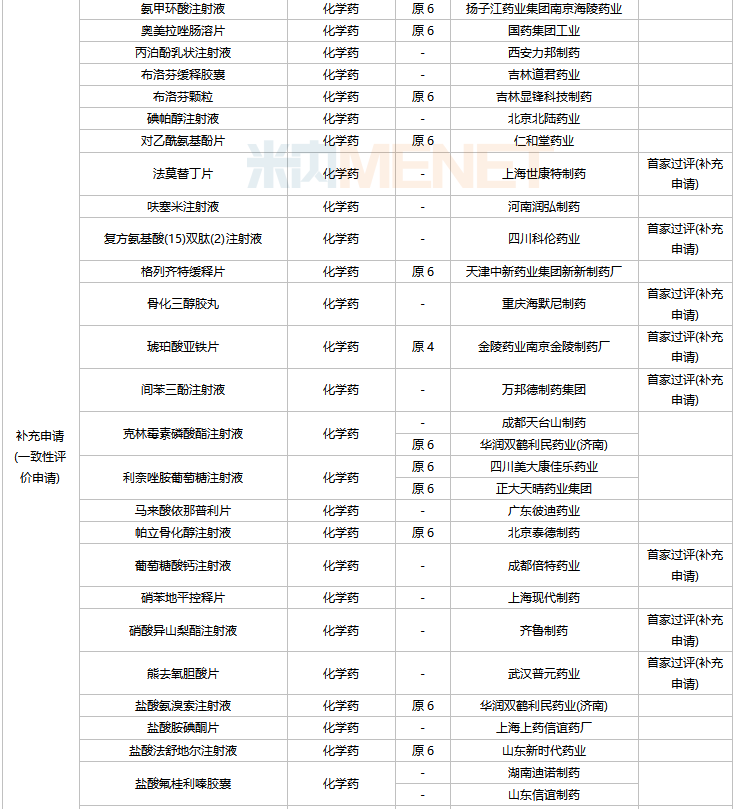
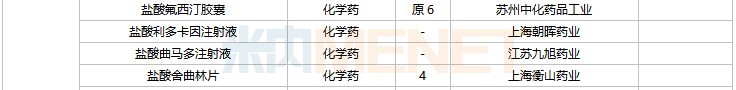
2022年2月,齊魯制藥的他達拉非口溶膜、湖南明瑞制藥的左奧硝唑分散片、湖南華納大藥廠的左奧硝唑膠囊等三款新劑型改良新藥獲批。玉溪嘉和生物的生物類似藥注射用英夫利西單抗獲批。
44個仿制藥獲批(含進口5.2類),氨氯地平氯沙坦鉀片(II)(北京韓美藥品)、昂丹司瓊口溶膜(江蘇恒瑞醫藥)、對乙酰氨基酚甘露醇注射液(江蘇恒瑞醫藥)、硫酸鎂鈉鉀口服用濃溶液(濟川藥業集團)為國內首仿獲批。
41個存量品種有企業過評,其中法莫替丁片、復方氨基酸(15)雙肽(2)注射液、骨化三醇膠丸、琥珀酸亞鐵片、間苯三酚注射液、葡萄糖酸鈣注射液、硝酸異山梨酯注射液、熊去氧膽酸片、注射用阿莫西林鈉舒巴坦鈉等9個品種首次有企業過評。
2月上市申請品種及一致性評價品種獲批情況

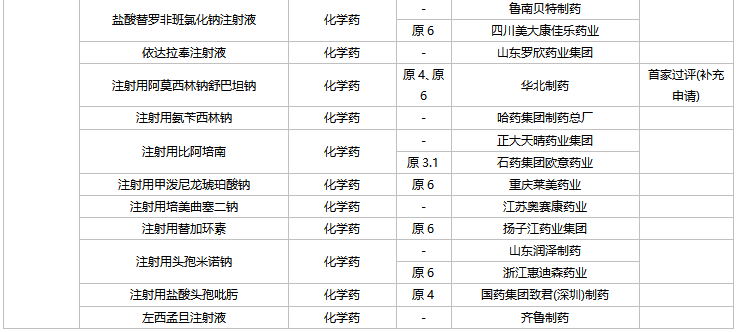
數據來源:米內網MED2.0藥品審評數據庫、CDE、NMPA;相關統計字段按藥品名稱統計,時間截至2022年2月28日;藥物作用靶點以及適應癥整理自公開資料。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!