
2022-03-04 16:50:04來源:藥智網瀏覽量:599
導讀:盲目me too是不行的。
自信達生物PD-1在美國FDA的審批受阻以來,創新藥市場悲觀情緒再度蔓延,不過這并沒有持續太久。
2022年2月28日,傳奇生物傳來好消息,公司自主研發的BCMA靶向CAR-T療法西達基奧侖賽(英文商品名:CARVYKTI?,英文通用名ciltacabtagene autoleucel,簡稱Cilta-cel)正式獲得美國FDA批準上市, 用于治療復發或難治性多發性骨髓瘤(R/R MM)患者。
這是繼2019年百濟神州澤布替尼后,第二款由中國企業研發,獲FDA批準的抗癌新藥。也是傳奇生物自成立以來第一款獲批上市的產品。

優秀的臨床數據才是出海的底氣
對比信達生物PD-1本身的me-too屬性及利用單一國家數據報批,本次傳奇生物Cilta-cel優秀的臨床試驗為其獲得批準提供了基礎。
1.FDA認為信達生物現有的試驗并非是臨床未滿足的需求,現有的同類藥物K藥已經滿足了需求。而傳奇生物的BCMA CAR-T美國只有一款產品(BMS/藍鳥的Abecma)并且在有效性和安全性上做到了best in class。
2.FDA認為信達生物臨床終點設計存在缺陷,以PFS而非是OS;而傳奇生物主要終點設置為ORR,與已獲批的Abecma設置標準對應。
3.FDA認為信達生物單一中國病人的生物多樣性無法確認;而傳奇生物采取的是多中心臨床(美國、日本、歐盟等)。
基于此,在獲批之前,大家對Cilta-cel的期待一直很高。
當然,Cilta-cel的底氣還在于優秀的臨床數據。
在關鍵的CARTITUDE-1研究中,97例R/R MM患者出現了早期、深度持久的緩解,總緩解率(ORR)高達98%(95%CI:92.7-99.7),78%的患者獲得了嚴格的完全緩解(sCR,95%CI:68.8-86.1)。在18個月的中位隨訪時間中,中位緩解持續時間(DOR)為21.8個月(95% CI,21.8-無法預估)。這證明了Cilta-cel是靶向BCMA的多發性骨髓瘤的BIC產品。
全球上市CAR-T療法一覽
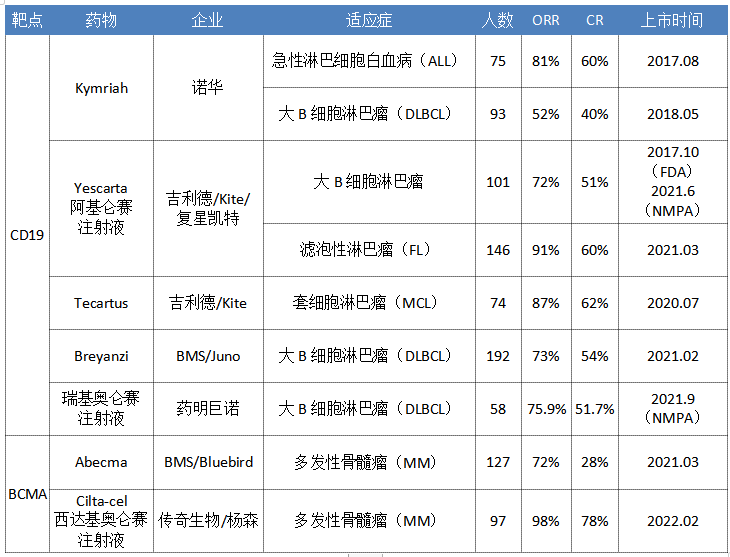
數據來源:藥智數據、企業公告等
FIC/BIC出海加速
創新藥為什么一定要出海?當然是為了追求創新市場最大化。
面臨國內集采政策與國家醫保談判所帶來的藥價壓力,大家開始意識到國內市場很難再有10億美元以上的重磅炸彈級藥物。僅局限于國內市場的藥企將面臨研發投入無法收回的困境。在此趨勢下,走國際化路線,參與全球競爭將是中國藥企未來的必然選擇。
據悉,早在2009年,恒瑞醫藥的磷酸瑞格列汀臨床研究就進行了中美雙報,并獲得了批準。
不過,直到2017年,我國正式加入國際人用藥品注冊技術協調會(ICH)之后,本土藥企創新藥進行中美雙報和同步開發才成為主流。2017年之后中美雙報的臨床獲批數量較2017年前翻了近10倍。
2019年,澤布替尼成為中國首個在美國獲批的本土研發抗癌新藥。
澤布替尼開展了全球多中心、頭對頭試驗:ALPINE研究和SEQUOIA研究,針對臨床具有統治地位的伊布替尼和苯達莫司汀+利妥昔單抗(B+R治療方案)發起挑戰,成功證明自己的同類最優潛力。
百濟神州的付出很快得到了回報。2021年,澤布替尼全球累計銷售額約14億元,同比增長423%。在美國全年銷售額為1.157億美元,同比增長535%。而且,澤布替尼2021年在美國已新增兩項適應癥,今年底有望再增兩項適應癥,成長潛力巨大。
2022年2月,傳奇生物BCMA CAR-T療法西達基奧侖賽獲得美國FDA批準上市,成為新的里程碑。Cilta-cel的定價為46.5萬美元,其主要競爭者百時美施貴寶的Abecma定價為41.95萬美元。強生曾預估Cilta-cel有望達到50億美元的銷售峰額。
結語
從澤布替尼到Cilta-cel的成功出海,都在告訴我們,具有臨床價值的創新藥才是市場期待的,扎堆的me too行不通。創新藥出海,要么像百濟神州,敢于開展“頭對頭”研究證明自己BIC屬性;要么像傳奇生物,在立項之初便獨辟蹊徑,將研發方向定位為解決未被滿足的臨床需求,選擇全新靶點進行研究。
希望未來國內能孵化出更多FIC、BIC,造福患者。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!