
2022-01-11 14:34:22來源:藥智網瀏覽量:591
導讀:今年,這些生物公司命運將會如何?
在中國進行的臨床試驗能否獲得美國的批準?結果即將揭曉。
2022年,美國FDA將決定多個中國造的PD-(L)1單抗能否在美國上市,包括:信達/禮來(信迪利單抗)、君實生物/Coherus(特瑞普利單抗)、康方生物(派安普利單抗)、百濟神州/諾華(替雷利珠單)。
2022年美國FDA關于PD-(L)1 單抗的審批計劃
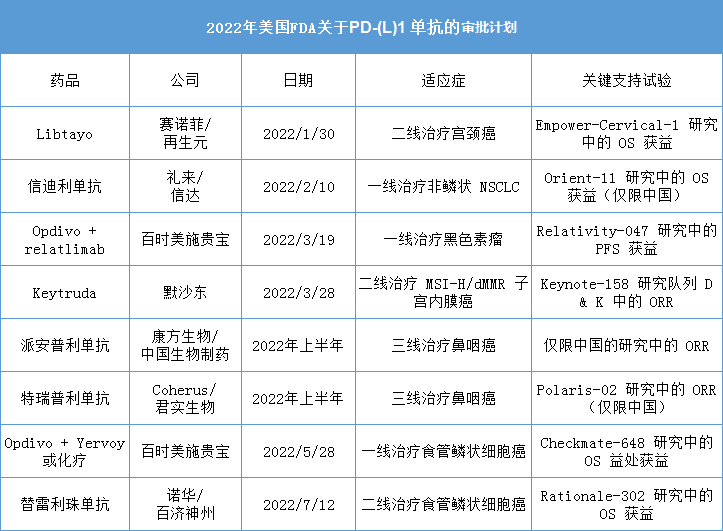
資料來源:evaluate
PD-(L)1全球都在“卷”
根據藥智數據,截至2022年1月6日,PD-1靶點藥物全球臨床試驗總數量已達3471項,其中中國(CDE注冊)為675項,約占全球的19.5%。數據顯示,全球PD-1臨床試驗數量從2012年開始飛速增長,并于2016-2020年間達到相對穩定的高峰,2021年開始有所下降。
PD-1研究在全球1-3期臨床試驗占比分別是13%、47%和26%,剩余占比為1/2期,4期,3/4期等。
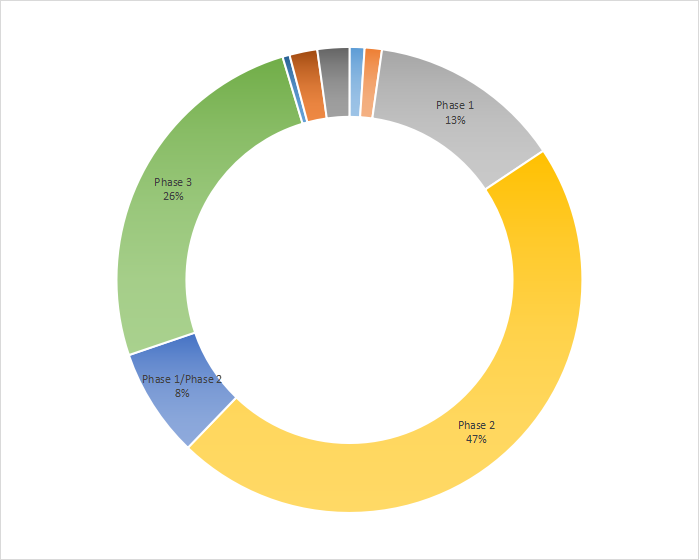
數據來源:藥智數據
截至目前,中國共有12款PD-(L)1獲批上市(8款為國產新藥,4款為進口藥)。
美國共上市11個PD-1類生物制品,涵蓋7個上市品種。
默沙東:Keytruda
在所有上市的PD-(L)1單抗中,默沙東公司的Keytruda為銷售冠軍。
Keytruda是全球第二款獲批上市的PD-1藥物,Keytruda自上市以來已獲批超20項腫瘤適應癥。目前正在開展的1400余項臨床試驗中,與其他腫瘤治療途徑結合的臨床試驗超過1000余項。
2020年,Keytruda全球銷售額143.80億美元,2021年前三季度銷售額為125.78億美元。作為PD-1/L1抑制劑的領頭羊,Keytruda有望于2025年登頂全球暢銷藥榜首,預計全球銷售額將突破220億美元。
2021年8月,美國FDA受理了Keytruda的一份補充生物制品許可申請(sBLA):作為一種單藥療法,用于治療在任何情況下經先前系統治療后疾病進展、且不適合進行根治性手術或放療的微衛星高不穩定性(MSI-H)或錯配修復缺陷(dMMR)晚期子宮內膜癌患者。PDUFA日期為2022年3月28日。
百時美施貴寶:Opdivo
銷售額排名第二的是百時美施貴寶的Opdivo,2020年銷售額為79.2億美元,2021年前三季度銷售額為60.3億美元。
今年,Opdivo或將再收獲兩項一線治療適應癥。
美國FDA已受理LAG-3阻斷抗體relatlimab與PD-1阻斷抗體Opdivo固定劑量組合的生物制品許可申請(BLA),并授予了優先審查。PDUFA日期為2022年3月19日。
另一項適應癥,Opdivo聯合抗CTLA-4療法Yervoy、Opdivo聯合化療(氟尿嘧啶+順鉑),一線治療不可切除的晚期、復發或轉移性食管鱗狀細胞癌(ESCC)成人患者,PDUFA日期為2022年5月28日。
4大國產PD-1出海!結果即將揭曉
2021年讓人印象深刻的詞,除了創新出海、醫保談判等,還有“失敗”。
去年12月初,萬春醫藥的普那布林遭到了FDA的“勸退”。FDA在回應函中表示,單一注冊試驗的結果不足以證明效益,需要進行第二次良好的對照試驗以滿足支持適應癥的實質性證據要求。其中,臨床III期入組美國患者人數較少也是被拒的原因之一,在臨床III期入組患者中,僅有13%來自美國和澳大利亞,剩余87%均來自中國。
不久前,美國FDA專家Pazduer博士又在會議上表示,新藥獲批僅靠一個國家的臨床數據,比如只靠中國的臨床數據,顯然是有問題的,這和美國在臨床試驗中努力增加患者多樣性的原則背道而馳。他的觀點被解讀成,美國FDA可能會對臨床數據完全來自中國的新藥收緊審核。
對于正在尋求出海的多個國產PD-(L)1單抗,投資者不免擔憂。不過,能否獲批結果很快就會知道了。
特瑞普利單抗
去年2月,君實生物與美國生物藥公司Coherus就特瑞普利單抗在美國和加拿大的開發和商業化達成合作。3月,君實生物披露公告,已經向FDA提交特瑞普利單抗用于治療復發或轉移性鼻咽癌的BLA。
特瑞普利單抗是全球首個獲批鼻咽癌治療的抗PD-1單抗。截至目前,美國FDA沒有批準過任何腫瘤免疫療法作為鼻咽癌的治療選擇,而特瑞普利單抗已獲美國FDA用于治療食管癌、黏膜黑色素瘤、鼻咽癌及軟組織肉瘤等4項孤兒藥資格認定,美國FDA還授予特瑞普利單抗2項突破性療法認定,并于2021年12月被授予優先審評,將10個月標準審評時間縮短至6個月。
特瑞普利單抗采取的是“滾動申請”,即藥企在申請新藥上市許可時,可以將申報文件分批次提交FDA進行審評,而無需等待申報文件全部完成后才向FDA提交申請,此舉可縮短新藥的審評周期。
信迪利單抗
信達生物是第二家向FDA提交PD-1上市申請的國產創新藥企。2021年5月,美國FDA正式受理了信迪利單抗聯合培美曲塞和鉑類用于非鱗狀非小細胞肺癌(NSCLC)一線治療的新藥上市申請BLA。
信達生物采取的是“正常申請”,通常需要10個月時間,耗時更長,但因為君實生物目前還沒有完成申請,仍然處于滾動中的狀態。而信達生物比較明確的一點是,FDA對信迪利單抗的上市申請作出決議的目標日期是2022年3月前。
派安普利單抗
康方生物是第三家向FDA遞交PD-1上市申請的國內企業,派安普利單抗(AK105)向美國FDA提交BLA申請的適應癥為:三線治療轉移性鼻咽癌。
派安普利單抗是中國首個在FDA的RTOR(實時腫瘤審評)項目下進行BLA的PD-1藥物。
據悉,加入RTOR計劃的藥物,相較過去快速審評通道、突破性療法或者孤兒藥等方式,批準所需時間將大大縮短,是FDA藥物審評最快的通道。
替雷利珠單抗
2021年9月,美國FDA受理了替雷利珠單抗的新藥上市申請(BLA),用于治療既往經系統治療后不可切除、復發性局部晚期或轉移性食管鱗狀細胞癌(ESCC)患者。PDUFA目標日期為2022年7月12日。
早在2021年1月,諾華就與百濟神州達成合作與授權協議,諾華獲得替雷利珠單抗在美國、加拿大、墨西哥、歐盟、英國、日本等多個國家的開發、生產和商業化權利,總交易金額達22億美元,而百濟神州獲得的首付款就高達6.5億美元,刷新了中國新藥“出海”首付金額的歷史記錄。百濟神州此次出海似乎信心滿滿。
結語
PD-(L)1賽道日益擁擠,國內“內卷”尤其嚴重,再加上醫保價格戰激烈,因此“出海”被認為是重要商業路徑。
但“出海”也不是一件容易的事。
2021年以來,在10項PD-(L)1單抗“懸而未決”的加速批準中,有四項由于響應率低而被自愿撤回。其余六項在 2021 年 4 月的腫瘤藥物咨詢委員會(ODAC)會議上進行了討論:三項計劃被撤回;一項轉換為常規批準,用于更有限的適應癥;另外兩項正在進行驗證性試驗和監管審查。
由此可見,在PD-(L)1的審核上,美國FDA也已經調高了難度。
在這場國產PD-1“出海大戰”中,2022年將是重要的一年,美國FDA首張上市批文何時獲得、花落誰家,讓我們拭目以待。
參考來源:
1.https://www.evaluate.com/vantage/articles/events/company-events/days-reckoning-immune-checkpoint-blockers
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!