
2021-11-09 15:49:05來源:藥智網瀏覽量:347
導讀:遍地開花,火熱的背后會僅是一樣“煙花”?
近期關于熱點賽道CD19靶點藥物喜訊不斷。首個CD19靶向抗體偶聯藥物(ADC),Zynlonta治療惡性淋巴瘤在歐盟進入審查,在中國進入2期臨床。諾華復發/難治性濾泡性淋巴瘤新藥!CD19 CAR-T細胞療法Kymriah在美歐進入審查 ...
悄然間,CD19靶點集齊了ADC、單抗、雙抗、CAR-T四大高手,同臺打擂,熱度比肩PD-1。一起縱觀CD19靶點布局,探討未來發展之路。
(一)CD19靶點簡介
CD19是表達于B淋巴細胞及濾泡樹突狀細胞的表面蛋白,屬于免疫球蛋白(Ig)超家族成員,位于16號染色體短臂上,分子量約95KD。細胞外有N端及兩個C2-Ig區,一個跨膜區,細胞內有C端及含9個酪氨酸殘基的高度保守功能區。
B細胞惡性腫瘤是常見的血液惡性腫瘤,盡管多數患者對目前的一線治療有反應,但復發率高、預后差。
近年來,CD19作為B細胞惡性腫瘤免疫治療的分子靶點受到極大的關注。
首先,CD19只在正常和惡性B細胞表達,幾乎不在其他組織表達。
其次,CD19在B細胞惡性轉化過程中不丟失,難治/復發性病例依然有效。
再次,CD19在造血干細胞和pro-B細胞不表達,治療停止后,B細胞可以得到有效的補充。
憑借這些特點,以CD19為靶點治療血液腫瘤的藥物逐步嶄露頭角,并有望成為主流的臨床治療方法。
(二)CD19藥物一覽
(1)單抗
Viela Bio是一家專注于炎癥和自身免疫性疾病領域的創新藥物開發的制藥企業,總部位于美國馬里蘭州。2020年6月11日,公司的抗CD19單抗Inebilizumab(Uplizna,MEDI-551)獲FDA批準上市,用于治療成人視神經脊髓炎譜系疾病 (NMOSD)。國內豪森擁有Inebilizumab的開發和商業化權益。
NMOSD 是一種罕見、嚴重、復發性的神經炎癥性自身免疫疾病,以視神經和脊髓的炎性病變為特征。
Inebilizumab 在美國上市基于一項評估 Uplizna 療效和安全性的 N-MOmentum 臨床試驗。該試驗入組 230 位成年患者,其中有 213 名患者呈抗 AQP4 抗體陽性。
為期 197 天的研究顯示,與安慰劑治療組相比,接受 Uplizna 治療的 161 名抗 AQP4 抗體陽性患者的 NMOSD 復發風險降低了 77%。
Inebilizumab作用機制
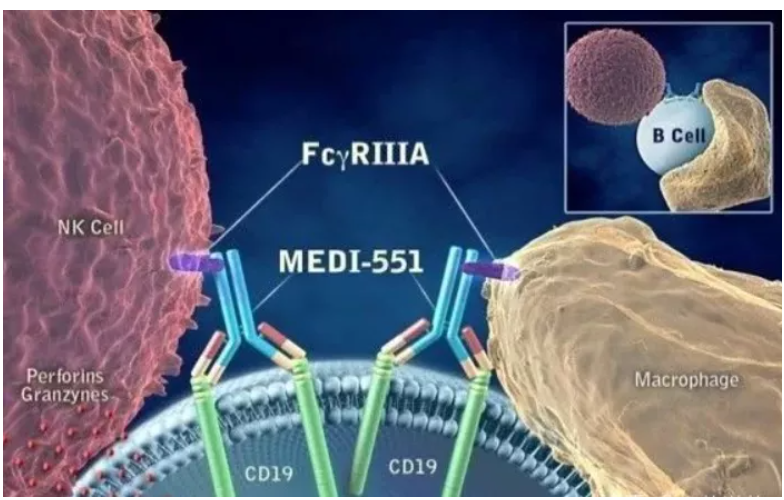
數據來源:Viela Bio
Tafasitamab是一款CD19單抗,由Xencor公司基于XmAb蛋白質工程平臺開發,其所包含的XmAb工程化Fc結構域可以通過ADCC和ADCP介導B細胞裂解。
2020年7月,FDA批準Tafasitamab聯合來那度胺治療不適合自體造血干細胞移植的成人r/r DLBCL患者。試驗結果顯示,71名患者接受了治療,ORR達55%(39/71),其中CR達37%,PR達18%,mDoR達21.7個月。
2021年8月,諾誠健華以3500萬美元的首付款和最高8250萬美元的里程碑費用獲得Tafasitamab在大中華區的開發及商業化權力。
Tafasitamab結構
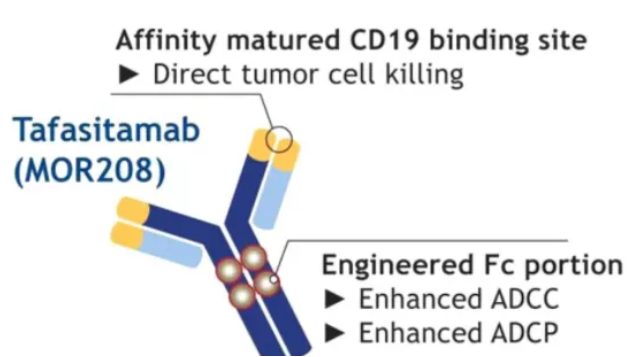
數據來源:諾誠健華
(2)雙抗
靶向CD19的雙抗獲批時間遠早于CD19單抗。
早在2014年,FDA即批準倍林妥莫雙抗用于成人和兒童復發或難治性前體B細胞ALL患者。
倍林妥莫雙抗(Blincyto,Blinatumomab,倍利妥)是一款雙特異性CD19導向的CD3 T細胞銜接分子,原研為安進公司。
Blincyto一端可以與B細胞表面表達的CD19結合,另一端可以與T細胞表面表達的CD3結合。通過連接CD19惡性B淋巴細胞與CD3+T淋巴細胞,Blincyto可介導T細胞對腫瘤細胞的溶解。相對分子量為55KDa。
Blincyto結構
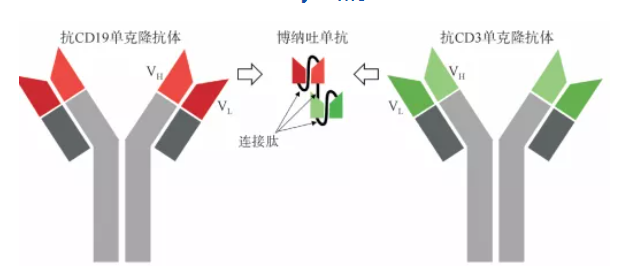
數據來源:安進
博納吐單抗的獲批主要基于TOWER試驗,試驗結果表明,Blincyto相比化療顯著改善r/r B-ALL成年患者的OS(7.7個月VS 4個月),12周完全緩解率為34%VS 16%,持續緩解時間(DOR)為7.3個月VS4.6個月。
在國內,百濟神州擁有Blincyto在中國的權益。2020年10月31日,百濟神州與安進建立全球腫瘤戰略合作關系,在中國開發和商業化注射用Blincyto。
2020年12月,NMPA附條件批準Blincyto用于治療成人復發或難治性前體B細胞急性淋巴細胞白血病(ALL)。
(3)CAR-T
目前,全球共6款CAR-T細胞療法獲批上市,其中五款均為CD19 CAR-T。
2021年,我國先后批準了CD19 CAR-T益基利侖賽注射液和瑞基奧侖賽注射液的上市申請。
益基利侖賽注射液是復星凱特從美國Kite Pharma(吉利德科學旗下公司)引進 YESCARTA技術、并獲授權在中國進行本地化生產的靶向CD19自體CAR-T細胞治療產品。
2021年6月,益基利侖賽注射液獲NMPA批準,成為國內首款上市的CAR-T療法,適應癥為復發或難治性大B細胞淋巴瘤。
益基利侖賽注射液的獲批基于關鍵性臨床研究ZUMA-1的積極數據,2017年12月公布的1年隨訪結果顯示:最佳總緩解率為82%,完全緩解率達到了54%;2018年12月公布的2年隨訪結果維中位隨訪27.1個月,仍有39%的受試者持續緩解,其中37%的受試者持續完全緩解。2019年12月公布了3年隨訪結果:中位隨訪時間39.1月,總生存率為47%,中位生存時間達到25.8月。
瑞基奧侖賽注射液是藥明巨諾研發的一款以CD19抗原為靶點的自體CAR-T療法。
2021年9月1日,國家藥品監督管理局(NMPA)批準藥明巨諾CAR-T藥物瑞基奧侖賽上市,用于治療復發/難治大B細胞淋巴瘤。
瑞基奧侖賽注射液的獲批基于RELIANCE試驗,試驗結果表明,在58例可評估有效性的患者中,ORR達75.9%,CR達51.7%。中位隨訪時間8.9個月, 6個月DOR、PFS和OS分別為60.0%、54.2%和90.8%。
瑞基奧侖賽注射液

數據來源:藥明巨諾
(4)ADC
Loncastuximab Tesirine(Zynlonta)是一款CD19 ADC藥物,2021年4月獲FDA批準上市,適應癥為復發性或難治性大B細胞淋巴瘤成人患者。是全球第一個也是唯一一個獲批的CD19靶向ADC。
Loncastuximab Tesirine由人源化抗人CD19單克隆抗體通過Linker與吡咯并苯并二氮雜卓(PBD)二聚體細胞毒素偶聯而成。一旦與表達CD19的細胞結合,Zynlonta就會被細胞內化,隨后釋放出細胞毒素,該毒素能不可逆地與DNA結合,從而產生阻止DNA鏈分離的強力鏈間交聯,從而破壞復制等必要的DNA代謝過程,最終導致細胞死亡。
Loncastuximab Tesirine的獲批基于LOTIS 2試驗,試驗結果表明,Loncastuximab Tesirine3線及以上治療DLBCL的ORR達48.3%,CR達24.8%。不良事件方面,由于不涉及T細胞激活,無CRS和NT毒性,主要的毒性為血液毒性。
在國內,ADC Therapeutics和瓴路藥業于2020年底成立合資公司Overland ADCT BioPharma,共同開發Loncastuximab Tesirine。2021年3月2日,Loncastuximab Tesirine獲CDE批準臨床,目前處于臨床Ⅰ期。
Zynlonta結構
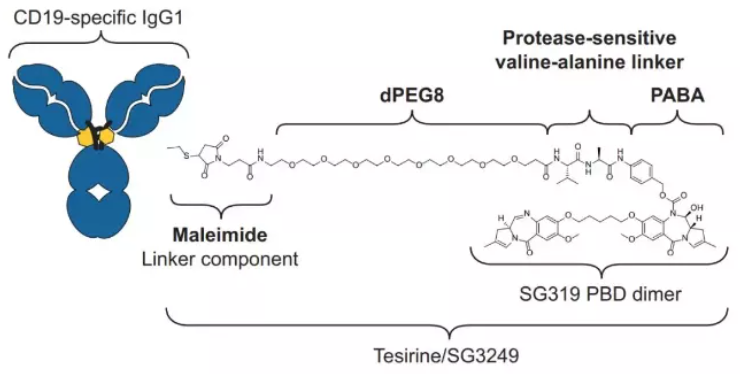
數據來源:ADC Therapeutics
(三)結語
CD19是表達于B淋巴細胞及濾泡樹突狀細胞的表面蛋白,憑借其在B細胞表面高表達而在其他細胞表面低表達,以及治療停止后,B細胞可以得到有效補充等優點,已成為B細胞淋巴瘤重要的治療靶點。
目前,以CD19為靶點的單抗、雙抗、ADC、CAR-T藥物已相繼上市,為晚期B細胞淋巴瘤患者提供了多種治療手段。但是,在熱鬧研發的背后,也有觀點認為針對CD19的研發已過于扎堆,火熱的賽道背后是否是一場泡沫,研發的同質化問題值得深思。
聲明:本文系藥方舟轉載內容,版權歸原作者所有,轉載目的在于傳遞更多信息,并不代表本平臺觀點。如涉及作品內容、版權和其它問題,請與本網站留言聯系,我們將在第一時間刪除內容!